Valorar el impacto de la introducción del tratamiento endovascular en pacientes con hemorragia subaracnoidea espontánea aneurismática (HSAa) en un centro de medio-bajo volumen.
Material y métodosEstudio observacional retrospectivo donde se comparan los resultados clínicos de pacientes con HSAa en 2 períodos, antes y después de disponer de tratamiento embolizador. Las variables estudiadas más relevantes fueron: modalidad de tratamiento, mortalidad intrahospitalaria y diferida, complicaciones intraprocedimiento, tasas de resangrado y vasoespasmo, y resultados al final del seguimiento medidos mediante la escala de resultado de Glasgow (GOS).
ResultadosSe trató en total a 71 pacientes en 2 períodos: 2010-2011 (32 pacientes; 19 clipajes, 6 embolizaciones,7 no tratados) y 2012-2013 (39 pacientes; 3 clipajes, 34 embolizaciones, 2 no tratados). Ambas cohortes no presentaron diferencias significativas en cuanto a edad, sexo, grado clínico al ingreso, tipo y localización de los aneurismas y puntuación de Fisher, así como en mortalidad intrahospitalaria (28,1% vs. 25,6%, p=0,35), resultado clínico valorado según la puntuación de GOS (salvo en GOS 5: 43,37% vs. 53,8%, p=0,045), tasa de hidrocefalia e incidencia de vasoespasmo sintomático. La segunda cohorte obtuvo mejores resultados agregados respecto a la primera para GOS 1+2+3 (36,3% vs. 43,75%, p=0,034) y para GOS 4+5 (61,5% vs. 56,25%, p=0,078). El porcentaje de pacientes que no fueron tratados fue significativamente inferior en el segundo período (5,1% vs. 21,8%, p<0,01), así como la tasa de resangrados (0% vs. 9,4%, p<0,01). En el segundo período se trataron los pacientes de forma más precoz (2,51 vs. 3,95 días) y la estancia en Unidad de Cuidados Intensivos y total fueron menores (15,2 y 24,6 vs. 10,3 y 18 días), diferencias en el límite de la significación estadística.
ConclusionesEl tratamiento endovascular permitió tratar un porcentaje mayor de pacientes con HSAa con una disminución en la tasa de resangrados. Este hecho se tradujo en una modesta reducción en la morbimortalidad.
To evaluate the impact of introducing endovascular therapy for patients with aneurysmal subarachnoid haemorrhage (aSAH) in a medium-low volume centre.
Material and methodsA retrospective observational study was conducted by comparing the clinical outcome of patients with aSAH before and after introducing endovascular therapy in our centre. The main variables analysed were: type of treatment, hospital and late mortality, intra-procedural morbidity, rate of re-bleeding and vasospasm, and clinical outcome according to the Glasgow Outcome Score (GOS).
ResultsSeventy-one patients were treated in two periods: 2010-2011 (32 patients; 19 clipped, 6 coiled, 7 untreated), and 2012-2013 (39 patients, 3 clipped, 34 coiled, 2 untreated). No significant differences were found in age, sex, clinical grade at admission, type and location of aneurysm, Fisher score, or in hospital mortality (28.1% vs 25.6%, P=.35), GOS (except for GOS 5: 43.37% vs 53.8%, P=.045), rate of hydrocephalus and rate of vasospasm. The second cohort obtained better results for aggregated GOS 1+2+3 (36.3% vs 43.75%, P=.034) and for GOS 4+5 (61.5% vs 56.25%, P=.078). The percentage of patients left untreated was significantly lower in the second period (5.1% vs 21.8%, P<.01), as well as the rate of re-bleeding (0% vs 9.4%, P<.01). Patients were treated earlier (2.51 vs 3.95 days), and hospital and total stay were lower (15.2 and 24.6 vs 10.3 and 18 days) in the second period, these differences not reaching statistical significance.
ConclusionsEndovascular therapy allowed treating more patients with aSAH, and with a lower re-bleeding rate. This led to a modest reduction in morbidity and mortality.
La hemorragia subaracnoidea espontánea de causa aneurismática (HSAa) es un derrame hemático arterial en el espacio subaracnoideo provocado por la rotura de un aneurisma cerebral. Se trata de una enfermedad con una historia natural extremadamente grave que afecta a personas de edad media y que asocia una elevada morbimortalidad. Aunque supone alrededor del 7% de todos los eventos neurovasculares agudos1, es responsable del 27% de todos los años de vida perdidos antes de los 65 años relacionados con los ictus2. Al menos un 10% de los afectados fallecen antes de llegar al hospital3,4, la mortalidad hospitalaria se encuentra en torno al 30%5 y más de la mitad de los supervivientes, en general personas cuya edad implica importantes responsabilidades familiares y laborales, quedan con secuelas físicas, neuropsicológicas y/o algún grado de incapacidad6,7.
Desde hace 4 décadas se han desarrollado y perfeccionado tratamientos médicos, quirúrgicos y de intervencionismo endovascular dirigidos a prevenir el resangrado y el vasoespasmo, complicaciones que frecuentemente siguen a la rotura de un aneurisma. Así mismo, se han introducido en la práctica clínica distintos sistemas de monitorización de parámetros de función neurovascular, optimizando la calidad asistencial del paciente neurocrítico en las Unidades de Cuidados Intensivos (UCI) mediante la denominada monitorización cerebral multiparamétrica o multimodal8-12.
En los últimos años, algunas organizaciones y sociedades científicas han publicado diversas guías de práctica clínica para el manejo de la HSAa donde se sistematizan las recomendaciones diagnósticas y terapéuticas en función del refrendo bibliográfico basado en criterios de medicina basada en la evidencia y en el consenso de expertos4,5,13-15. Con todo, el impacto de estos avances y estudios sobre la supervivencia global ha sido modesto16.
Se ha demostrado que ciertos factores clínicos (edad avanzada, mayor escala de gravedad al ingreso, aneurismas de circulación posterior, mayor cantidad de derrame en la TC inicial, tabaquismo, consumo de gran cantidad de alcohol y/o hipertensión) implican un mayor riesgo de sangrado y/o un peor pronóstico vital por sí mismos, independientemente de la modalidad de tratamiento empleado4,5,13-15. Por otro lado, conocidos estudios (como ISAT, BRAT, ISUIA) parecen ir confirmando que, globalmente, el tratamiento endovascular conlleva una cierta menor morbimortalidad respecto al clipaje quirúrgico, especialmente en aneurismas de circulación posterior, aunque precisa controles angiográficos frecuentes, retratamientos e implica un leve pero mayor riesgo de resangrado17-21.
Se ha postulado que los pacientes manejados en centros expertos, subespecializados, con alto volumen anual de pacientes, en aquellos en los que se siguen de manera estricta las recomendaciones de las guías terapéuticas, o cuando el manejo integral de los pacientes en la fase aguda tiene lugar en una UCI con un equipo multidisciplinar, presentan un mejor pronóstico final4,5,13-15. Sin embargo, existe cierto debate sobre el valor real de estos factores en el pronóstico vital y funcional de los pacientes que sobreviven a una HSAa22. La enorme casuística española recientemente publicada por Lagares et al.23 en una revisión prospectiva de pacientes con HSAa, procedente de la base de datos del Grupo de Trabajo de Patología Vascular (GTPV) de la Sociedad Española de Neurocirugía (SENEC), aporta información muy interesante respecto al manejo y pronóstico de estos pacientes. Curiosamente, en dicho trabajo sobre 2.150 aneurismas rotos, pertenecientes a 10 centros españoles que tratan un volumen medio-alto, no se pudo correlacionar una mejoría del pronóstico con una adherencia fiel a las guías clínicas o con un mayor volumen de pacientes tratados por centro.
En el presente trabajo describimos y comparamos los resultados de 2 cohortes de pacientes diagnosticados de HSAa en nuestro centro: en un período previo a la implantación de un departamento de neurorradiología intervencionista, por lo que se trata de una serie de casos preferentemente intervenidos, frente a un segundo período en el cual ya se dispone de posibilidad de tratamiento endovascular, y en el que los pacientes fueron mayoritariamente embolizados. Se trata de un centro considerado de medio-bajo volumen, con neurocirujanos entrenados en técnicas microquirúrgicas y en patología vascular. Así mismo, revisamos los factores pronósticos relacionados con la enfermedad y las áreas de controversia en torno a la interpretación de dichos factores y de los resultados funcionales a medio y largo plazo.
Material y métodosSe trata de un estudio observacional retrospectivo de una cohorte de pacientes consecutivos diagnosticados de HSAa y tratados en nuestro centro hospitalario. Se establecieron 2 grupos diferenciados temporalmente: aquellos tratados en el período 2010-2011 (cuando no se disponía de tratamiento endovascular en el centro, por lo que la mayoría fueron intervenidos y algunos fueron derivados de forma discrecional a otros centros para tratamiento endovascular) y los tratados entre 2012-2013 (período en el que se disponía tanto de tratamiento quirúrgico como endovascular dentro de un protocolo clínico específico del centro basado en un compendio-resumen de las guías de tratamiento de la HSAa de las diversas sociedades científicas)4,5,13-15.
Se definió como caso a todo paciente que llegó vivo al hospital y en el que se confirmó la presencia de HSA en la TC craneal urgente o mediante punción lumbar, y en el que se comprobó la existencia de un aneurisma responsable del sangrado mediante angiografía y/o angio-TC cerebral. Se empleó la angio-TC cerebral como prueba de imagen de diagnóstico inicial, aunque a todos los pacientes que posteriormente fueron intervenidos se les realizó arteriografía preoperatoria. En el estudio se incluyó también a aquellos pacientes que ingresaron en situación clínica crítica con pronóstico infausto desde el momento del ingreso en UCI, a los que se les diagnosticó el aneurisma mediante angio-TC, pero en los que no dio tiempo a realizar arteriografía ni a ser tratados por fallecer muy precozmente. Se excluyeron todos los casos de aneurismas incidentales, HSA perimesencefálica, HSA de origen traumático y aquellos debido a rotura de malformaciones vasculares distintas de los aneurismas o por otras etiologías (trombosis de senos venosos, etc.).
Se obtuvieron datos clínicos y de imagen de los pacientes desde los registros guardados en la historia clínica informatizada del centro, así como de las bases de datos particulares de los servicios de Cuidados Intensivos, Neurocirugía y Neurorradiología Intervencionista.
La política del centro, según el protocolo de manejo consensuado por los 3 servicios (sistematizado a partir del inicio del segundo período), es realizar el estudio angiográfico diagnóstico confirmatorio lo antes posible tras el sangrado (en horario de mañana o al día siguiente laborable; no se dispone de guardia de alerta de neurorradiólogo intervencionista) y el tratamiento preferentemente precoz (antes de 72 h), tanto quirúrgico como endovascular, en función de la disponibilidad de sala, material y personal. En general, se tiende a favorecer el tratamiento endovascular como primera opción, especialmente en pacientes en mal grado, en aneurismas de circulación posterior y en el resto de localizaciones, salvo en arteria cerebral media (ACM). Se plantea cirugía de entrada en pacientes con hematomas voluminosos y en aquellos en buen grado en los que técnicamente la embolización se considera de forma consensuada que conlleva un riesgo elevado de complicaciones intra o posprocedimiento. Todos los casos se discuten en sesión conjunta de las 3 especialidades y se opta por un tratamiento de forma consensuada, tras valorar detenidamente el riesgo-beneficio de cada caso.
Algunas de las variables clave estudiadas fueron: modalidad de tratamiento, morbimortalidad hospitalaria y resultados clínicos según la puntuación de GOS al alta y al final del seguimiento. Los pacientes fueron seguidos tras el alta hospitalaria, tanto en la consulta externa de Neurocirugía como en la consulta externa de Neurorradiología Intervencionista. Se realizó una angiografía de control al mes tras la cirugía y a los 6 meses tras la embolización. En los pacientes con aneurisma excluido estable se realizó angio-RM arterial anualmente. En los pacientes con aneurisma residual se realizaron retratamientos y angiografías de control cada 6 meses hasta su exclusión completa.
El análisis estadístico de variables y las comparaciones de datos se realizaron mediante el programa SPSS versión 19, considerando como diferencia significativa un valor de p de 2 colas menor de 0,05. Las variables cuantitativas y cualitativas ordinales fueron estudiadas mediante t de Student (o mediante U de Mann-Whitney en las distribuciones no normales, previo test de Kolmogorov-Smirnov). Las variables cualitativas fueron analizadas mediante el test de la chi al cuadrado.
El Hospital Universitario de Burgos es centro de referencia para todos los pacientes del área provincial (Burgos) y de 2 provincias más (Soria y La Rioja), con una población de referencia total de aproximadamente 750.000 habitantes. La remisión de pacientes con HSA espontánea desde los diversos hospitales del área queda bajo criterio de los facultativos que los atienden en primer lugar en esos centros y supeditado a la disponibilidad de camas libres en la UCI de este centro. Por este motivo, no se asegura una captura completa de toda la casuística posible, desde el punto de vista de la incidencia poblacional. En este análisis se han excluido todos aquellos aneurismas no rotos encontrados durante las pruebas diagnósticas realizadas para el estudio de la HSA (en pacientes con aneurismas múltiples).
ResultadosA lo largo de los 4 años de estudio (2010-2013) ingresaron un total de 71 pacientes con HSAa (63,3% mujeres), con una mediana de edad de 55 años. En el primer período (2010-2011) fueron 32 pacientes los ingresados con diagnóstico de HSAa, mientras que en el segundo período (2012-2013) se atendieron 39 pacientes. La incidencia anual promediada de HSAa durante el período de estudio en el área de referencia fue de 2,37 casos por 100.000 habitantes, dato sensiblemente inferior a lo reportado en la literatura (alrededor de 9 casos por 100.000)4,5,13, posiblemente en relación con las consideraciones epidemiológicas referidas en el apartado anterior.
Todos los pacientes diagnosticados de HSAa fueron ingresados en la UCI, independientemente del grado clínico a su llegada. El número total de aneurismas diagnosticados fue de 79, teniendo en cuenta los casos de aneurismas múltiples (3 pacientes con aneurismas dobles en el primer período y un paciente con 3 aneurismas, y 3 pacientes con 2 aneurismas en el segundo período). Uno de los pacientes con aneurisma no roto perteneciente al segundo período fue tratado de forma satisfactoria mediante embolización fuera del período de estudio, por lo que no se consideró en el análisis. La tabla 1 resume los principales hallazgos, características clínicas y resultados de ambas cohortes.
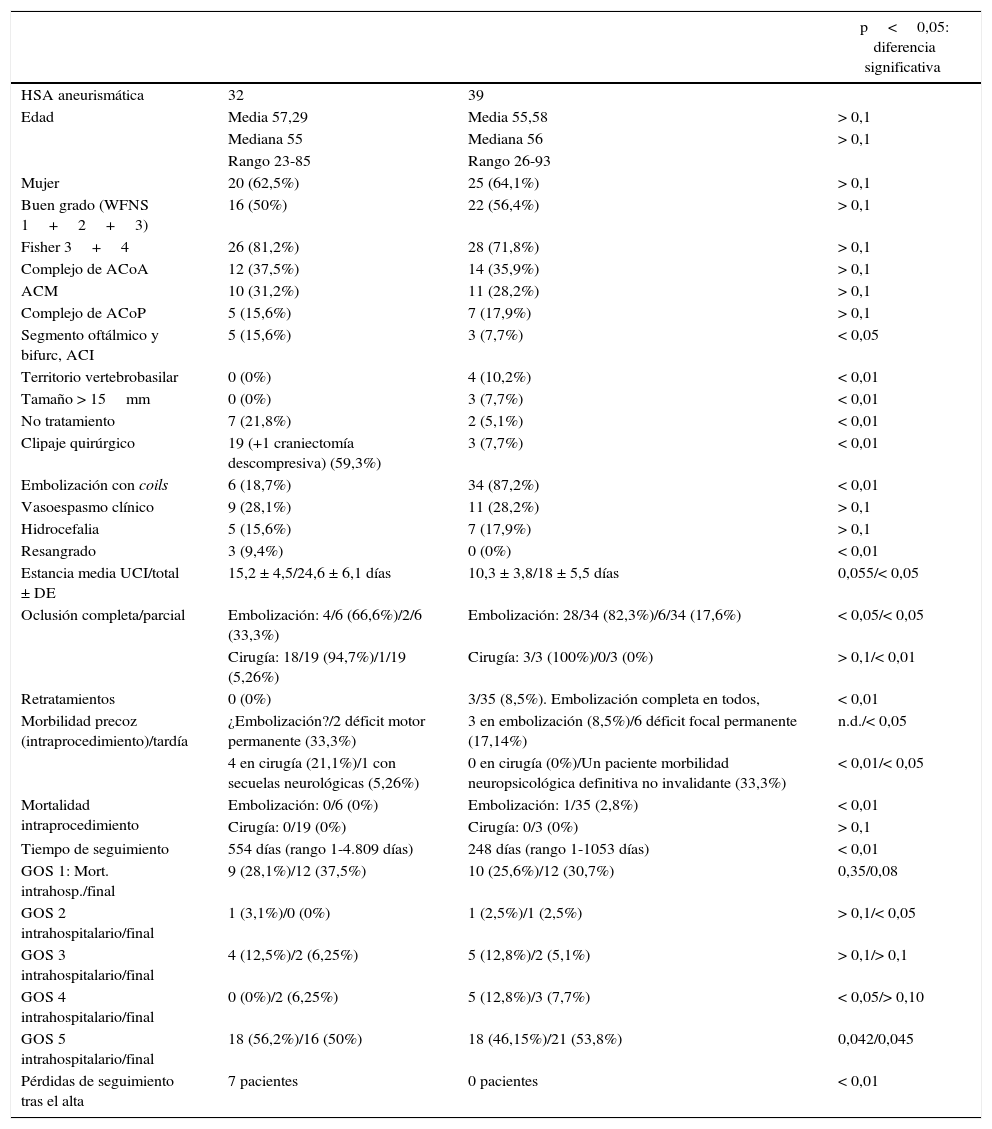
Datos demográficos y clínicos de los 2 grupos de pacientes
| p<0,05: diferencia significativa | |||
|---|---|---|---|
| HSA aneurismática | 32 | 39 | |
| Edad | Media 57,29 | Media 55,58 | > 0,1 |
| Mediana 55 | Mediana 56 | > 0,1 | |
| Rango 23-85 | Rango 26-93 | ||
| Mujer | 20 (62,5%) | 25 (64,1%) | > 0,1 |
| Buen grado (WFNS 1+2+3) | 16 (50%) | 22 (56,4%) | > 0,1 |
| Fisher 3+4 | 26 (81,2%) | 28 (71,8%) | > 0,1 |
| Complejo de ACoA | 12 (37,5%) | 14 (35,9%) | > 0,1 |
| ACM | 10 (31,2%) | 11 (28,2%) | > 0,1 |
| Complejo de ACoP | 5 (15,6%) | 7 (17,9%) | > 0,1 |
| Segmento oftálmico y bifurc, ACI | 5 (15,6%) | 3 (7,7%) | < 0,05 |
| Territorio vertebrobasilar | 0 (0%) | 4 (10,2%) | < 0,01 |
| Tamaño > 15mm | 0 (0%) | 3 (7,7%) | < 0,01 |
| No tratamiento | 7 (21,8%) | 2 (5,1%) | < 0,01 |
| Clipaje quirúrgico | 19 (+1 craniectomía descompresiva) (59,3%) | 3 (7,7%) | < 0,01 |
| Embolización con coils | 6 (18,7%) | 34 (87,2%) | < 0,01 |
| Vasoespasmo clínico | 9 (28,1%) | 11 (28,2%) | > 0,1 |
| Hidrocefalia | 5 (15,6%) | 7 (17,9%) | > 0,1 |
| Resangrado | 3 (9,4%) | 0 (0%) | < 0,01 |
| Estancia media UCI/total ± DE | 15,2 ± 4,5/24,6 ± 6,1 días | 10,3 ± 3,8/18 ± 5,5 días | 0,055/< 0,05 |
| Oclusión completa/parcial | Embolización: 4/6 (66,6%)/2/6 (33,3%) | Embolización: 28/34 (82,3%)/6/34 (17,6%) | < 0,05/< 0,05 |
| Cirugía: 18/19 (94,7%)/1/19 (5,26%) | Cirugía: 3/3 (100%)/0/3 (0%) | > 0,1/< 0,01 | |
| Retratamientos | 0 (0%) | 3/35 (8,5%). Embolización completa en todos, | < 0,01 |
| Morbilidad precoz (intraprocedimiento)/tardía | ¿Embolización?/2 déficit motor permanente (33,3%) | 3 en embolización (8,5%)/6 déficit focal permanente (17,14%) | n.d./< 0,05 |
| 4 en cirugía (21,1%)/1 con secuelas neurológicas (5,26%) | 0 en cirugía (0%)/Un paciente morbilidad neuropsicológica definitiva no invalidante (33,3%) | < 0,01/< 0,05 | |
| Mortalidad intraprocedimiento | Embolización: 0/6 (0%) | Embolización: 1/35 (2,8%) | < 0,01 |
| Cirugía: 0/19 (0%) | Cirugía: 0/3 (0%) | > 0,1 | |
| Tiempo de seguimiento | 554 días (rango 1-4.809 días) | 248 días (rango 1-1053 días) | < 0,01 |
| GOS 1: Mort. intrahosp./final | 9 (28,1%)/12 (37,5%) | 10 (25,6%)/12 (30,7%) | 0,35/0,08 |
| GOS 2 intrahospitalario/final | 1 (3,1%)/0 (0%) | 1 (2,5%)/1 (2,5%) | > 0,1/< 0,05 |
| GOS 3 intrahospitalario/final | 4 (12,5%)/2 (6,25%) | 5 (12,8%)/2 (5,1%) | > 0,1/> 0,1 |
| GOS 4 intrahospitalario/final | 0 (0%)/2 (6,25%) | 5 (12,8%)/3 (7,7%) | < 0,05/> 0,10 |
| GOS 5 intrahospitalario/final | 18 (56,2%)/16 (50%) | 18 (46,15%)/21 (53,8%) | 0,042/0,045 |
| Pérdidas de seguimiento tras el alta | 7 pacientes | 0 pacientes | < 0,01 |
La localización de los aneurismas corresponde al aneurisma que se consideró responsable del sangrado (en caso de aneurismas múltiples). Los pacientes con un día de seguimiento fueron aquellos que llegaron al hospital en coma arreactivo, sin reflejos de tronco y que fallecieron casi inmediatamente.
Cualquier valor de p mayor de 0,1 (diferencia no significativa) se muestra en la tabla como p>0,1 de manera genérica.
Se trató a 32 pacientes consecutivos de HSAa con una mediana de edad de 55 años. La localización de los aneurismas y las características clínicas de la cohorte se muestran en la tabla 1. Aparecieron aneurismas múltiples en 3 pacientes (dobles aneurismas), lo que corresponde al 9,4%. El tiempo medio ± desviación estándar ingreso-tratamiento de exclusión fue de 3,95 ± 1,02 días.
Se intervinieron mediante clipaje quirúrgico 19 pacientes (59,3%), se embolizaron 6 (18,7%, remitidos a otros centros y que posteriormente volvieron a nuestro centro) y no se trataron 7 pacientes (21,8%). La razón de no tratarse se debió a una combinación de mal estado clínico del paciente (coma arreactivo inicial) y edad avanzada (> 75 años) en todos los casos. Un paciente precisó una craniectomía descompresiva, con resangrado posterior, que finalmente no se trató. La estancia media en la UCI y la total fue de 15,2 ± 4,5 y 24,6 ± 6,1 días, respectivamente. Para el cálculo de la estancia media y del tiempo hasta el tratamiento primario se tuvo en cuenta la estancia en otros centros, tanto en UCI como en planta a partir de los informes de alta de esos centros.
Se diagnosticó vasoespasmo clínico en 9 pacientes (28,1%), uno de los cuales precisó craniectomía descompresiva. Cuatro pacientes desarrollaron una focalidad nueva que se resolvió con terapia médica y en los 5 restantes persistió el déficit al alta. Un paciente falleció a los 8 días por infarto cerebral extenso. Se diagnosticó hidrocefalia en la primera TC en 5 pacientes (15,6%), de los cuales 4 precisaron drenaje ventricular externo inicial y posteriormente sistema de derivación de líquido cefalorraquídeo definitivo. Durante todo el período de seguimiento se constataron 3 resangrados (9,3%): uno ocurrió tras 2 años, debido a la rotura de otro aneurisma diferente; otro ocurrió a los 6 meses en un paciente en el que inicialmente se decidió no tratamiento, y otro ocurrió precozmente en un paciente que se decidió no tratar inicialmente y en el que se había realizado una descompresiva sin clipaje.
Se objetivaron complicaciones quirúrgicas en 4 de los 19 pacientes intervenidos (21,1%): empeoramiento del déficit motor inicial en 2 casos, de los cuales uno persistió al alta; parálisis de iii par que se resolvió a los 3 meses en un paciente, y disfasia mixta que se resolvió completamente durante el ingreso. No se produjeron muertes intraoperatorias ni resangrados de aneurismas clipados. Falleció un paciente intervenido (5,26%) a los 12 días debido a infarto cerebral de ACM secundario a vasoespasmo. No disponemos de las complicaciones de los pacientes que fueron embolizados en otros centros.
La mortalidad global intrahospitalaria (durante la estancia en la UCI y la planta) fue del 28,1% y la mortalidad tardía (al final del seguimiento) fue del 37,5%. La mayor parte de los fallecimientos ocurrieron en pacientes con mal estado clínico a la llegada y en los que se decidió no tratar. El seguimiento medio de la cohorte fue de 554 días. Se perdieron datos clínicos de seguimiento en 7 pacientes. Los resultados según GOS se muestran en la tabla 1.
Resultados del segundo período: 2012-2013 (con disponibilidad de tratamiento endovascular en el centro)Se trató a 39 pacientes consecutivos de HSAa, con una mediana de edad de 56 años. La localización de los aneurismas y las características clínicas de la cohorte se muestran en la tabla 1. Se diagnosticaron aneurismas múltiples en 4 pacientes (3 dobles y uno triple), lo que corresponde al 10,3%. El tiempo medio ingreso-tratamiento fue de 2,51 ± 0,96 días.
Se intervinieron mediante clipaje 3 pacientes (7,7%), se embolizaron 34 (87,2%) y no se trataron 2 pacientes (5,1%) debido al mal estado clínico (coma arreactivo y midriasis bilateral al ingreso). La estancia media en la UCI y la total hospitalaria fue de 10,3 ±3,8 y 18 ± 5,5 días, respectivamente.
El tratamiento endovascular se realizó antes de 72h del ingreso en todos los casos (14 aneurismas se embolizaron inmediatamente tras la angiografía diagnóstica). Se emplearon coils de platino y balón de remodelado en todos los casos, salvo 2 que precisaron stent (en tratamientos diferidos por recanalización del aneurisma). Se obtuvo una oclusión completa en 28 de 34 pacientes (82,3%) y oclusión parcial en 6 (17,6%). En el control arteriográfico a los 6 meses se evidenció recanalización por compactación de coils en 3 pacientes (8,5%): uno con embolización completa previa y 2 con embolización parcial. Los 3 se retrataron y se consiguió oclusión completa verificada en la arteriografía tras 6 meses y al final del seguimiento (tasa de oclusión completa final del 91,2%). No ocurrieron resangrados en los pacientes retratados ni en los embolizados completamente en el primer tratamiento.
Ocurrieron complicaciones agudas intraprocedimiento en 3 pacientes: un paciente falleció por rotura del aneurisma al introducir el tercer coil durante el tratamiento primario; un paciente presentó un infarto de rama distal de ACM debido a un agregado plaquetario, y un paciente presentó una rotura contenida del aneurisma durante el procedimiento de embolización, sin repercusión clínica. Las complicaciones diferidas (entre 2 y 12 días) fueron debidas a vasoespasmo clínico en 11 pacientes (28,2%): un paciente falleció, 6 pacientes empeoraron neurológicamente y el resto recuperaron el déficit focal. Se produjeron 2 defunciones: un paciente a los 15 días debido a fracaso multiorgánico en el contexto de neoplasia de páncreas diseminada y otro paciente a los 2 meses por rotura de una malformación arteriovenosa de tronco. Se constató hidrocefalia al ingreso en 7 pacientes (17,9%) de este segundo período. Se precisaron drenaje ventricular y sistema definitivo de derivación en los 7 casos.
Los 3 pacientes intervenidos mediante clipaje presentaron sendos aneurismas de ACM. Se obtuvieron oclusión completa y controles de imagen estables en todos ellos. Un paciente desarrolló trastornos neuropsicológicos que le han impedido la vuelta al trabajo previo, aunque lleva una vida dentro de la normalidad. Los otros 2 pacientes evolucionaron favorablemente, sin defectos neurológicos y han recuperado su vida previa.
Las tasas de morbimortalidad debidas a la embolización fueron del 8,5 y el 2,8%, y las relacionadas con el vasoespasmo del 17,1 y el 2,8%, respectivamente. La tasa de mortalidad global de la cohorte al alta de planta y al final del seguimiento fue del 25,6 y el 30,7%, respectivamente. El seguimiento medio de los pacientes del segundo período fue de 248 días y no se perdió ningún paciente tratado. Los resultados según GOS se muestran en la tabla 1.
Se constata una tendencia hacia una discreta mejoría del pronóstico en el segundo período: mortalidad intrahospitalaria (28,1% vs. 25,6%, p=0,35) y mortalidad diferida (37,5% vs. 30,7%, p=0,08), y un porcentaje mayor de buenos resultados (GOS 5 al final del seguimiento: 43,7% vs- 53,5%, p=0,045). Por otro lado, destacan las diferencias en cuanto al porcentaje de pacientes que no fueron tratados, sensiblemente inferior en la cohorte preferentemente embolizada (5,1% vs. 21,8%, y 17% en la base de datos del GTPV) y en la tasa de resangrados (0% vs. 9,4%, y 8,7).
En el segundo período se trató a los pacientes de forma algo más precoz y la estancia en UCI y total son discretamente menores, diferencias en el límite de la significación estadística (tabla 1). Nuestras 2 cohortes tienden a acumular más pacientes en los valores extremos de la puntuación de GOS (GOS1: fallecidos y GOS5: recuperación completa) respecto a la serie del GTPV SENEC, que presenta mayor porcentaje de pacientes con GOS intermedios (tabla 2). Agrupando por GOS 1+2+3 (muerte o mal resultado) y GOS 4+5 (buen resultado), la segunda cohorte de nuestra serie muestra un mejor resultado: 36,3% vs. 43,75% para GOS 1+2+3 (p=0,034) y 61,5% vs. 56,25% para GOS 4+5 (p=0,078).
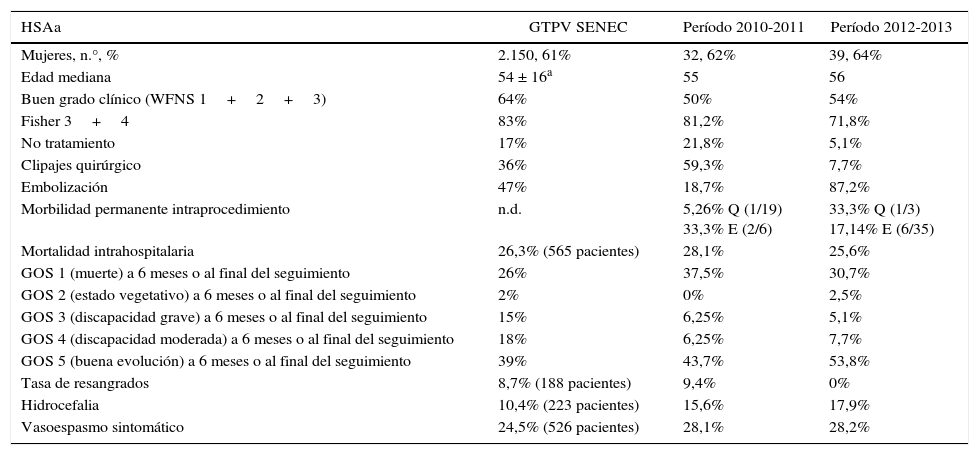
Comparación de resultados entre serie española del GTPV de la SENEC y los 2 períodos de nuestra serie
| HSAa | GTPV SENEC | Período 2010-2011 | Período 2012-2013 |
|---|---|---|---|
| Mujeres, n.°, % | 2.150, 61% | 32, 62% | 39, 64% |
| Edad mediana | 54 ± 16a | 55 | 56 |
| Buen grado clínico (WFNS 1+2+3) | 64% | 50% | 54% |
| Fisher 3+4 | 83% | 81,2% | 71,8% |
| No tratamiento | 17% | 21,8% | 5,1% |
| Clipajes quirúrgico | 36% | 59,3% | 7,7% |
| Embolización | 47% | 18,7% | 87,2% |
| Morbilidad permanente intraprocedimiento | n.d. | 5,26% Q (1/19) 33,3% E (2/6) | 33,3% Q (1/3) 17,14% E (6/35) |
| Mortalidad intrahospitalaria | 26,3% (565 pacientes) | 28,1% | 25,6% |
| GOS 1 (muerte) a 6 meses o al final del seguimiento | 26% | 37,5% | 30,7% |
| GOS 2 (estado vegetativo) a 6 meses o al final del seguimiento | 2% | 0% | 2,5% |
| GOS 3 (discapacidad grave) a 6 meses o al final del seguimiento | 15% | 6,25% | 5,1% |
| GOS 4 (discapacidad moderada) a 6 meses o al final del seguimiento | 18% | 6,25% | 7,7% |
| GOS 5 (buena evolución) a 6 meses o al final del seguimiento | 39% | 43,7% | 53,8% |
| Tasa de resangrados | 8,7% (188 pacientes) | 9,4% | 0% |
| Hidrocefalia | 10,4% (223 pacientes) | 15,6% | 17,9% |
| Vasoespasmo sintomático | 24,5% (526 pacientes) | 28,1% | 28,2% |
En esta tabla asumimos que las variables de resultado no cambian de forma sustancial entre el GOS a 6 meses en la serie nacional o al final del seguimiento (248 y 554 días de media) en nuestra serie, por lo que realizamos esa comparación. El GOS 1 al final de seguimiento y la mortalidad intrahospitalaria en la primera columna es igual por el redondeo.
E: Embolización; GOS: Glasgow Outcome Score; GTPV: Grupo de Trabajo de Patología Vascular; Q: quirúrgico; SENEC: Sociedad Española de Neurocirugía; WFNS: World Federation of Neurological Surgeons.
La casuística presentada en el apartado anterior permite una comparación directa con los datos publicados por el GTPV de la SENEC23, sobre una base de datos prospectiva de 2.150 pacientes con HSAa confirmada, manejados en 10 centros españoles de medio y alto volumen, en el período 2004-2012. En ambas series, tanto las variables demográficas y clínicas de presentación, como las variables de tratamiento y resultado, son similares aunque con algunas diferencias (tabla 2; datos comunicados por el Dr. Lagares, coordinador de la base de datos del GTPV SENEC). Se debe tener en cuenta que la tasa de resangrado y el porcentaje de pacientes no tratados en la base de datos del GTPV SENEC son datos promediados entre centros en los que preferentemente se emboliza y otros donde solo se realiza cirugía. Idealmente, sería más exacta una comparación, en términos de resangrado y de porcentaje de no tratados, entre nuestra segunda cohorte y otra serie española con proporción de tratamiento embolizador también elevado.
Sin embargo, es notable la coincidencia en lo referente a edad, el sexo, el grado clínico al ingreso, el tipo y la localización de los aneurismas y la puntuación de Fisher. Así mismo, ambas series no presentan, en general, diferencias significativas en lo relativo a la tasa de hidrocefalia que precisa derivación definitiva, incidencia de vasoespasmo sintomático y mortalidad intrahospitalaria, aunque sí una tendencia significativa a obtener mejores resultados con la embolización, al estratificar los resultados en buenos (GOS 4+5) y malos (GOS 1+2+3). Estos datos corroboran la tendencia generalizada a tratar más a pacientes en los centros donde preferentemente se emboliza, aunque esto no implique una mejora sustancial en el resultado final; es decir, se consigue tratar a más pacientes, un porcentaje de los cuales posteriormente fallece o queda con secuelas. Nuestros resultados muestran, por una parte, que el tratamiento embolizador consiguió rescatar a algún paciente más de la muerte, a expensas de cierta mayor discapacidad, y por otro lado, se obtuvo un porcentaje significativamente mayor de resultados buenos en los supervivientes. Es evidente que la proporción de pacientes intervenidos ha disminuido en gran medida entre los 2 períodos (únicamente 3 clipajes en el segundo período). Este desequilibrio merece reflexión, dado que probablemente generará cada vez mayor número de pacientes que precisen retratamientos (algunos de los cuales serán difíciles para ambas modalidades) y una pérdida de entrenamiento y experiencia quirúrgica.
Las principales limitaciones de este estudio tienen que ver con la relativamente pequeña casuística presentada, con el hecho de que se comparan datos clínicos obtenidos de las historias clínicas informatizadas de forma retrospectiva y el sesgo que introduce el hecho de que la elección de tratamiento se haya visto influenciada por la disponibilidad de cirujanos y radiólogos entrenados de forma diferente en cada período. Aunque la embolización generalmente permite tratar a pacientes mayores y en peor grado, dado el pequeño tamaño muestral y las características clínicas de los pacientes no tratados en el primer período, no puede asegurarse que pacientes de iguales características sí hubieran sido tratados en el segundo período.
Poner en marcha una unidad de Neurorradiología Intervencionista conlleva cierta curva de aprendizaje, a pesar de un entrenamiento previo adecuado. A la vista del porcentaje de embolizaciones completas estables (> 90%) y de la morbilidad intraprocedimiento (8,5%), puede afirmarse que el tratamiento endovascular en nuestro centro ha alcanzado un nivel de efectividad homologable al de cualquier otro departamento de Neurorradiología Intervencionista en un tiempo relativamente reducido.
Es bien conocido que la historia natural de la HSAa no tratada es mala desde el punto de vista de la supervivencia. La mortalidad debida al primer sangrado, resangrado precoz y vasoespasmo supera el 60-70% en el primer año4,11. Según Rinkel y Algra16, el tratamiento precoz de la HSAa (exclusión del aneurisma) ha conseguido un descenso de la tasa de mortalidad únicamente del 17% en términos absolutos, a lo largo de las últimas 3 décadas. Sin embargo, la incidencia de HSAa ha permanecido relativamente estable en torno a 9 casos por 100.000 habitantes y año4,5,13. En general, las grandes series prospectivas de aneurismas rotos y tratados proporcionan datos de supervivencia y de morbilidad permanente similares a los aquí comunicados17-21.
Efectividad de la embolizaciónAunque el tratamiento endovascular de los aneurismas cerebrales se viene realizando desde hace décadas mediante la introducción de espirales de platino (coils) en el interior del aneurisma para excluirlo de la circulación, con la publicación en 2002 del estudio ISAT17 y en 2003 del ISUIA18, esta técnica ha expandido de forma espectacular las indicaciones de tratamiento, tanto en aneurismas rotos como incidentales, e incluso en aquellos que presentan una anatomía vascular desfavorable, gracias a la implantación de técnicas asistidas. Las técnicas de remodeling (remodelado del cuello del aneurisma con balón intravascular), el uso de endoprótesis (stents para evitar la migración de los coils, stents recubiertos, stents diversificadores de flujo…) o la utilización de agentes embolizantes como el Onyx® (eV3-MTI, Irvine, CA, EE. UU.) ha supuesto un aumento de las opciones terapéuticas en las malformaciones vasculares en general y en los aneurismas intracraneales en particular, posibilitando el manejo endovascular de aneurismas considerados hace años solo tratables de manera quirúrgica24.
No obstante, hay que tener en cuenta que, además de las morbilidades asociadas a la HSA, existen complicaciones relacionadas con la técnica, bien intraprocedimiento o de manera diferida. Las complicaciones intraprocedimiento más frecuentes son la perforación del aneurisma, el tromboembolismo por formación de trombos o agregados plaquetarios y la migración de las espirales de platino a las arterias adyacentes, lo que provoca trombosis de la arteria (aunque actualmente existen dispositivos que permiten su extracción). En la literatura se comunica una incidencia de tromboembolismo en el tratamiento endovascular de aneurismas cerebrales en torno al 12%, y una tasa de rotura del aneurisma durante la implantación endovascular de coils del 4-5%25-27. Otras complicaciones que pueden surgir de manera diferida son el vasoespasmo, tromboembolismo diferido o recanalización del aneurisma por compactación de los coils de embolización28.
En la actualidad, el tratamiento endovascular de los aneurismas intracraneales presenta unos resultados ligeramente favorables respecto al quirúrgico, en cuanto a efectividad y buen resultado clínico a medio y largo plazo, aunque asocia una tasa de resangrado y recanalización del aneurisma también algo mayor. En un artículo reciente en el que se realiza un análisis del seguimiento a los 18 años de los pacientes de Reino Unido incluidos en el estudio ISAT, se comprueba que un 81% de los pacientes tratados de manera endovascular presentan un buen estado clínico e independencia (escala de Rankin modificada: mRS 0-2) frente a un 78% en los pacientes tratados con cirugía. En este análisis la probabilidad de un buen resultado clínico (seguir vivo y con mRS 0-2) comparado con el fallecimiento o dependencia en los 2 grupos favorece al tratamiento endovascular (odds ratio 1,33; intervalo de confianza del 95%, 1,08-1,65)19. En líneas generales, mediante el tratamiento endovascular se obtienen unas tasas cercanas al 90% de oclusión completa del aneurisma embolizado y una tasa de recanalización del aneurisma por impactación de los coils que precisa retratamiento en torno al 10-15%19.
Estos resultados también se hacen extensibles a los aneurismas de arteria cerebral media. Mortimer et al.29 publican una serie de 300 casos de aneurismas de ACM con unas tasas de oclusión completa y recanalización del 91,4 y el 4,3%, respectivamente. Vendrell et al.30 presentan unos resultados similares, con tasas de embolización completa del 89,5% y de recanalización del 10,5% en un estudio sobre 174 aneurismas de ACM embolizados. En un estudio prospectivo de 131 aneurismas de ACM, Gory et al.31 publican una tasa de oclusión completa del 84,4%, con una tasa de retratamiento del 7,4% de los aneurismas embolizados.
Cekirge et al.32 presentan una tasa de oclusión completa del 87,6% tras seguimiento a 2 años de pacientes con aneurismas en complejo de arteria comunicante anterior tratados de forma endovascular, con una tasa del 1,4% de morbimortalidad relacionada con el procedimiento. Lozier et al.33, en una revisión de aneurismas de circulación posterior embolizados, obtienen una tasa de complicaciones intraprocedimiento y morbilidad del 12,5 y el 5,1% respectivamente. También concluyen que se obtuvo una tasa de oclusión completa u oclusión casi completa del 91,0% y la tasa estimada de recanalización fue de un 10%.
La HSA que se produce por la rotura de un aneurisma es la responsable del vasoespasmo arterial que tiene lugar en las arterias cerebrales en los días posteriores al sangrado (entre el 2.° y el 21.° día tras el sangrado, con un pico de mayor incidencia entre los días 5.° a 14.°), proceso desencadenado por el efecto irritante de la oxihemoglobina sobre las arterias, que responden con vasoconstricción. El mejor conocimiento de la fisiopatología de este proceso ha influido en el manejo del mismo, fundamentalmente mediante la infusión de vasodilatadores intraarteriales o mediante angioplastia de la arteria espasmodizada34. El vasoespasmo causa isquemia sintomática e infarto cerebral en aproximadamente el 20-30% de los pacientes con HSAa. La gravedad de los síntomas depende de la arteria afectada y el grado de circulación colateral35. Aunque en 2004, Goddard et al.36 publican que el método de tratamiento no tiene influencia en la incidencia o duración del vasoespasmo, según Rabinstein et al.37 y, más recientemente, Gross et al.38, parece existir una mayor tasa de vasoespasmo e infarto posterior en los pacientes con aneurismas rotos tratados de manera quirúrgica respecto de los que se tratan de forma endovascular. En la serie que presentamos, la tasa de vasoespasmo fue similar en ambos períodos.
Tratamiento y estancia en la Unidad de Cuidados IntensivosDesde las guías de práctica clínica publicadas por el GTPV de la SENEC4 se recomienda que todo paciente diagnosticado de HSAa debe ingresar en la UCI debido a la potencial gravedad de esta enfermedad y a sus efectos, no solo a nivel del sistema nervioso central, sino sobre otros órganos. En la UCI, se los considera desde el ingreso pacientes neurocríticos de alta complejidad e inestables por definición. En el año 2011 tuvo lugar la Conferencia de Consenso Multidisciplinaria sobre los cuidados críticos de la HSA, organizada por la Neurocritical Care Society14, donde se acordaron importantes recomendaciones en torno a la actitud terapéutica desde el punto de vista del neurointensivista.
Aunque la literatura no aclara en qué modo influye en la evolución, el tiempo de ingreso en la UCI y en la planta tras una HSAa, es razonable suponer que una mayor estancia conlleva mayor riesgo de complicaciones nosocomiales y mayor gasto sanitario. En la serie que presentamos, la estancia en la UCI y total del segundo período (embolización) son menores, diferencias en el límite de la significación estadística. Este hecho, sin embargo, debe corroborarse en estudios prospectivos con mayor casuística antes de afirmar que el tratamiento embolizador acorta la estancia hospitalaria.
Las actuaciones médicas del intensivista en las HSAa han ido evolucionando paralelamente a la innovación técnica cada vez más presente en las UCI de última generación. Comenzaron con la conocida «triple H», actualmente con baja evidencia clínica14,39, hasta la realización de ecocardiografías a pie de cama, monitorización invasiva del gasto cardiaco en pacientes con complicaciones cardiopulmonares e inestabilidad hemodinámica o disfunción miocárdica14, pasando por la utilidad de la ecografía Doppler transcraneal y de la monitorización multimodal8-12. Todo esto busca detectar precozmente la aparición del deterioro neurológico diferido, fundamentalmente las complicaciones isquémicas40, presentes en un 25-30% tras una HSAa, tales como el vasoespasmo y la isquemia cerebral diferida (ICD). En la mencionada Conferencia de Consenso se definieron ambas: el vasoespasmo «se refiere al estrechamiento arterial después de una HSA, demostrado mediante imágenes radiográficas o ecográficas»14,41; mientras que la ICD «se refiere a cualquier deterioro neurológico (p. ej., hemiparesia, afasia o alteración de la consciencia) supuestamente relacionado con la isquemia que persiste durante más de una hora y no puede explicarse mediante otras anomalías fisiológicas apreciadas en los estudios radiográficos, electrofisiológicos o de laboratorio habituales»14,41. Es conocido que, hasta la fecha, únicamente la administración de nimodipino alcanza el máximo nivel de evidencia respecto a la prevención de las complicaciones isquémicas cerebrales diferidas13,39,42,43.
Por otro lado, la monitorización de la ICD se ha convertido en uno de los pilares del tratamiento actual de estos pacientes. Es precisa una monitorización clínica, radiológica y fisiológica principalmente en el período de alto riesgo de aparición (3.°-14.° días), cuyo objetivo es su detección precoz y el cambio en la actitud terapéutica según sus hallazgos. Ante la sospecha diagnóstica de ICD, inicialmente se procede a la optimización del tratamiento médico, centrándose en el estado hemodinámico del paciente. Cuando existe refractariedad al tratamiento instaurado, se considera el tratamiento endovascular (vasodilatadores intraarteriales o angioplastia) como terapia de rescate14. En general, no existen umbrales y directrices específicas respecto a cuándo empezar a tratar un paciente con sospecha de ICD, por lo que es muy importante disponer de la experiencia necesaria para llevar a cabo la implantación y la interpretación de las diferentes herramientas de monitorización y tratamiento ante la ICD14.
Se ha postulado que la existencia de Unidades de Cuidados Críticos neurológicos dirigidas por neurointensivistas en los centros de gran volumen reduce la mortalidad en pacientes con HSAa14,44. En general, en las guías de práctica clínica se recomienda tratar a este tipo de pacientes en centros de excelencia que dispongan de todas las técnicas terapéuticas, ingreso en UCI, bajo protocolos consensuados y por equipos que manejen un volumen mínimo de pacientes al año4,5,13-15. La realidad es que, al menos en España, la mayoría de las HSAa se tratan en centros de bajo volumen (menos de 20 casos/año)14. Según diversos estudios44,45, estos pacientes deberían tratarse en centros de gran volumen, debido a su implicación pronóstica. Sin embargo, este umbral de casuística no está perfectamente definido. Aunque frecuentemente se habla de más de 35 casos anuales, en la publicación de Lagares et al.23 sobre datos de centros españoles de medio-alto volumen se reconoce que el número de casos tratados por año no parece influir de forma decisiva en el pronóstico. Esta cuestión permanece sujeta a debate, por lo que no se puede afirmar que tratar estos pacientes en centros de bajo volumen pueda ser considerada una práctica incorrecta o no ética. En nuestra serie, perteneciente a un centro de bajo volumen, los resultados clínicos obtenidos (tasas de mortalidad intrahospitalaria, resangrado, obliteración del aneurisma, complicaciones intraprocedimiento, vasoespasmo clínico, hidrocefalia, mortalidad tardía y resultado según GOS) no difieren sustancialmente de los obtenidos en centros de mayor volumen23. Es posible que la calidad asistencial alcanzada, en un centro que dispone de un grupo multidisciplinar entrenado, con profesionales de las 3 especialidades involucradas y una UCI dotada de neuromonitorización, sea más relevante de cara al pronóstico que el mero número de casos atendidos anualmente. Por otra parte, tampoco parece que la adherencia estricta a las guías de práctica clínica suponga una diferencia significativa desde el punto de vista del pronóstico23.
Factores de riesgo modificables y no modificablesLos factores de riesgo asociados al pronóstico de esta enfermedad son diversos y, muchos de ellos, desafortunadamente nada o escasamente modificables. El sexo, la edad, el estado clínico tras la reanimación inicial, el tipo, el tamaño y la localización del aneurisma, la cantidad de derrame subaracnoideo medido en la TC o la presencia de enfermedades que predisponen al desarrollo de aneurismas son ejemplos de factores de riesgo importantes, aunque no modificables. Según las recientes revisiones sistemáticas y guías de práctica clínica, los más relevantes, desde el punto de vista de la supervivencia, siguen siendo la edad, el estado clínico al ingreso según la clasificación de la World Federation of Neurological Surgeons y la cantidad de sangre subaracnoidea según la puntuación de Fisher4,5,13-15.
Sin embargo, otros factores, como el tipo de tratamiento elegido para excluir el aneurisma, la aparición de daño cerebral secundario (causado por resangrado, isquemia cerebral diferida, hidrocefalia u otras causas), la experiencia del equipo que atiende al paciente, la disponibilidad de un equipo multidisciplinar, la adherencia estricta a las recomendaciones de la guías de manejo publicadas, el volumen anual de pacientes tratados, y el consumo de alcohol, el tabaquismo y la hipertensión arterial son factores sobre los que podemos influir, al menos parcialmente. No obstante, la mayoría de los estudios muestran que estos factores modificables producen un impacto poco relevante en el pronóstico final aun en condiciones óptimas, como se describe a continuación. La tabla 3 enumera y comenta someramente los principales factores asociados al pronóstico de la HSA, sobre la base de la información que se extrae de las publicaciones que revisan de forma sistematizada el tema4,5,13-15.
Resumen general de los factores de riesgo modificables, parcialmente y no modificables en el pronóstico de la HSAa
| Factores de riesgo | Comentario |
|---|---|
| No modificables | |
| Edad | Principal factor predictor (junto al grado clínico posreanimación al ingreso) de supervivencia. A mayor edad peor pronóstico tanto en clipados como en embolizados. Mayor riesgo de sangrado si se diagnostica el aneurisma a menor edad |
| Sexo femenino | Mayor incidencia de aneurismas rotos en mujeres. Igual morbilidad intraprocedimiento y GOS final. Mayor riesgo de crecimiento y rotura del aneurisma, sobre todo en fumadoras. Mayor riesgo de formación de aneurismas de novo |
| Grado clínico al ingreso (WFNS) | Principal factor implicado en el resultado final vital y funcional. En principio no modificable, a menos que se identificara precozmente el sangrado centinela cuando existe, antes del sangrado evidente |
| Puntuación de Fisher | Mayor riesgo de eventos neurológicos adversos diferidos relacionados con el vasoespasmo tras la HSA |
| HSA previa | Mayor riesgo de sangrado futuro por recidiva o formación de aneurisma de novo (especialmente en fumadores e hipertensos) |
| Familiar en primer grado con historia de HSA previa | Riesgo global aumentado de HSA, cuyo efecto se diluye al ajustar por otros factores de riesgo independientes. No justifica cribado de aneurismas en familiares |
| Dos o más familiares en primer grado con historia de HSA previa | Se recomienda cribado de aneurismas (10% de positivos), especialmente en mujeres y fumadores/hipertensos. Mayor riesgo cuanto más joven era el afectado de HSAa (fenómeno de anticipación genética) |
| Enfermedad genética predisponente a desarrollo de aneurismas (enfermedad poliquística renal, colagenopatías) | Riesgo aumentado de presencia y rotura de aneurismas incidentales. Se suele ofrecer cribado de aneurismas no rotos |
| Localización del aneurisma | Circulación posterior. Mayor riesgo de crecimiento y sangrado |
| Tamaño del aneurisma | Aneurismas gigantes. Mayor riesgo de sangrado. Mínimo riesgo de sangrado en aneurismas incidentales<5-7mm |
| Parcialmente modificables (sujeto a disponibilidad de material, personal, variabilidad clínica, etc.) | |
| Hipertensión arterial | Es un factor de riesgo importante parcialmente modificable para rotura de aneurismas (no independiente, confundido con otros factores) y quizá para la formación de aneurismas de novo |
| Centro de alto volumen | Dudoso mejor pronóstico vital a corto-medio plazo. Mayor porcentaje de pacientes tratados (a expensas de embolización) |
| Ingreso en UVI del 100% de pacientes independiente del grado clínico | Dudoso efecto sobre supervivencia y pronóstico funcional. En estudio |
| Monitorización multimodal (PIC, flujo sanguíneo cerebral, oximetría cerebral, microdiálisis, Doppler, etc.) | Dudoso efecto sobre supervivencia y pronóstico funcional. Potencial efecto positivo sobre anticipación de aparición de vasoespasmo sintomático. En estudio |
| Presencia de hidrocefalia. Necesidad de derivación ventriculoperitoneal | Dudoso efecto sobre supervivencia y pronóstico funcional. Causa de deterioro tardío y secuelas neuropsicológicas. DVE prolongado predispone a ventriculitis |
| Presencia de vasoespasmo sintomático | Empeora el pronóstico. Principal causa de morbimortalidad en supervivientes a la HSAa tratada |
| Resangrado | Empeora marcadamente el pronóstico. Principal causa de mortalidad en primeras horas en HSAa no tratada |
| Modificables | |
| Tabaco | Es el factor de riesgo modificable más importante para la formación de aneurismas, crecimiento y rotura de los mismos. Debe recomendarse su abstinencia |
| Alcohol | La ingesta aguda de grandes cantidades de alcohol es factor de riesgo para rotura de aneurismas. Debe recomendarse su abandono o moderación |
| Tipo de tratamiento | Leve a moderado aumento de morbimortalidad a corto-medio plazo en clipados frente a embolizados. Mayor incidencia de resangrados y necesidad de retratamiento en embolizados. Discreta diferencia en cuanto a supervivencia, nula diferencia en cuanto a la proporción de vegetativos persistentes o discapacitados leves y graves |
| Utilización de fibrinólisis intraventricular | Dudoso efecto sobre supervivencia y pronóstico funcional. Probable efecto beneficioso sobre vasoespasmo e hidrocefalia. En estudio |
| Adherencia estricta a guías de práctica clínica | Sin efecto beneficioso claramente establecido sobre supervivencia y pronóstico funcional a medio-largo plazo |
| Tratamiento de aneurisma no roto (o incidental), sin HSA previa | Demostrada menor morbimortalidad que en aneurismas rotos; no justifica cribado poblacional organizado de aneurismas no rotos salvo en ciertas subpoblaciones (véase el texto) |
Los únicos factores de riesgo realmente modificables e independientes para HSAa son 3: tabaco, abuso alcohólico e hipertensión13. El tabaquismo es el más importante e implica un riesgo aumentado de rotura del aneurisma en un factor de 2-346,47. Sin embargo, una vez diagnosticado un aneurisma, los factores predictores independientes de rotura del mismo son fundamentalmente el tamaño, la localización, la edad a la inversa, el consumo de tabaco (un riesgo que se triplica respecto a los no fumadores si el paciente persiste en el hábito)13 y la angioarquitectura del aneurisma. Por otro lado, los aneurismas tienden a crecer más en las mujeres, especialmente en las que fuman. Este dato es importante pues, antes de romperse, los aneurismas suelen crecer48. El consumo de alcohol, especialmente en grandes cantidades en ingestas agudas (> 150-200g/semana), parece asociarse a un aumento del riesgo de HSAa, tanto en hombres como en mujeres, independientemente de la edad, la hipertensión o el tabaquismo46. La historia previa de hipertensión arterial no es tan importante como factor de riesgo como lo es en el resto de ictus, aunque se sabe que aumenta el riesgo de rotura del aneurisma en un factor de 2,5 aproximadamente46,47. Sin embargo, este efecto se diluye ajustando por edad y tabaquismo, y su efecto sobre la formación de aneurismas de novo es dudosa47.
La historia familiar de HSAa se ha reconocido clásicamente como un factor de riesgo no modificable para rotura de aneurismas. Este factor queda fuertemente influenciado por otros factores de riesgo independientes (fundamentalmente hipertensión y tabaquismo), por lo que su efecto real es confuso13. Sin embargo, alrededor del 10% de las HSAa presentan antecedentes familiares49. Las probabilidades de encontrar un aneurisma en una prueba de cribado sobre personas con 2 o más familiares en primer grado afectados de HSAa alcanza el 10%50. Esta es la razón por la que se recomienda el cribado de aneurismas únicamente en pacientes con 2 o más familiares en primer grado afectados, o en subgrupos de alto riesgo, como los portadores de colagenopatías, en pacientes con hermanos que han tenido HSAa a edades muy tempranas y especialmente en familias con enfermedad poliquística renal13. El riesgo de desarrollar aneurismas de novo en pacientes con aneurismas tratados es del 0,6-1,1% anual, especialmente en mujeres y fumadoras48.
El tipo de tratamiento elegido tampoco parece influir demasiado en el pronóstico, por lo menos a medio y largo plazo. Los famosos estudios ISAT, ISUIA y BRAT, y sus reportes a largo plazo, han constatado un incremento en la utilización de la embolización como primera opción terapéutica, salvo en casos específicos, y un discreto mejor pronóstico vital respecto al clipaje quirúrgico17-21. La cirugía ha sido progresivamente relegada a casos concretos, algunos de los cuales implican cierta mayor complejidad: aneurismas gigantes con efecto de masa o que precisan cirugía de by-pass, un porcentaje cada vez menor de los aneurismas de ACM (a priori menos complejos), aneurismas distales de difícil acceso intraarterial y aneurismas parcialmente embolizados que por alguna razón no pueden ser retratados por vía endovascular.
El hecho de que haya disminuido marcadamente el número de pacientes que se intervienen, en nuestra opinión, está propiciando un menor entrenamiento y una pérdida de experiencia por parte de los cirujanos, en una patología que, aun en los centros donde se tratan todos los casos mediante cirugía, no ocupan al neurocirujano no dedicado exclusivamente a la patología neurovascular más de 4-5 veces al año por término medio. Este hecho, unido a que los aneurismas que no pueden embolizarse, suele plantear dificultades añadidas para las cuales la experiencia es previsiblemente cada vez más escasa; quizá genere un problema asistencial a medio plazo, al menos en España, donde la embolización ya se emplea de forma rutinaria y creciente (al menos en el 57% de los casos que se deciden tratar según la base de datos española)23 y donde ya se constata una sobrepoblación de neurocirujanos en formación o recién acabados, que podrían no haber recibido entrenamiento suficiente en este tipo de cirugía debido a la escasa casuística.
Wang y Heros22 recientemente han indicado que el pronóstico real funcional de los pacientes que sobreviven a la HSAa está falsa y positivamente sobrevalorado por diversas razones. Por un lado, muchos pacientes son erróneamente clasificados como de mal grado clínico debido a que son evaluados previamente a la completa reanimación inicial, o en presencia de hidrocefalia aguda no tratada o de hematomas de tamaño moderado o grande, que de ser evacuados permitirían clasificar a los pacientes como de mejor grado clínico. Por otro lado, las variables de resultado que generalmente se emplean en los estudios (GOS, mRS) no tienen en cuenta la funcionalidad del paciente en cuanto a las capacidades cognitivas, las actividades de la vida diaria y sobre su capacidad de volver plenamente a su vida previa, incluido el trabajo.
En el exhaustivo trabajo de Al-Khindi et al.6 publicado en 2010, los autores revisan la literatura respecto a las secuelas cognitivas y funcionales tras una HSAa y concluyen que los supervivientes presentan defectos de memoria (entre el 14-61%), de funciones ejecutivas (3-76%) y del lenguaje (0-76%) lo suficientemente graves como para afectar a las actividades de la vida diaria, vuelta al trabajo (incapaces de volver al mismo empleo entre el 40-80%) y calidad de vida (deterioro que puede persistir hasta 5 años y que puede empeorar con el tiempo). Además, frecuentemente se acompañan de depresión (5-50%), ansiedad (incidencia que triplica a la de la población general), fatiga crónica (al menos en el 30%) y trastornos del sueño (afecta al 37-45%). Por otra parte, en el estudio de Manning et al.51 se describe cómo algunas funciones del lóbulo frontal están típicamente alteradas en los supervivientes a una HSAa embolizados (flexibilidad cognitiva, capacidad para planificar, resolución de problemas, inhibición), mientras que otras suelen permanecer intactas (juicio, capacidad para realizar estimaciones), lo que podría explicar por qué muchos pacientes considerados como de buen resultado (GOS 5) experimentan defectos cognitivos graves e invalidantes para la vida diaria que persisten meses tras la HSAa.
En resumen, las grandes series de aneurismas rotos tratados tanto quirúrgica como endovascularmente publicadas en las últimas décadas han constatado un cierto estancamiento en el pronóstico vital (persiste un 30% de mortalidad hospitalaria, aun en las mejores manos) y un alto porcentaje de secuelas neurocognitivas y funcionales en los supervivientes. Los factores de riesgo que más influyen en la supervivencia del paciente que ha presentado una HSAa no parecen modificables, mientras que aquellos factores que sí podemos modificar, incluido el tipo de terapia aplicada, parecen no influir de forma significativa o hacerlo de manera modesta.
ConclusionesLa implantación de un departamento de Neurorradiología Intervencionista en nuestro centro ha permitido tratar un porcentaje mayor de pacientes con aneurismas cerebrales rotos, con una disminución en la tasa de resangrados, que se ha traducido en una modesta mejoría en el pronóstico a corto y medio plazo, medido en términos de supervivencia y de buenos resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Alfonso Lagares, por la información proporcionada sobre la base de datos de aneurismas rotos del Grupo de Trabajo de Patología Vascular de la Sociedad Española de Neurocirugía, y por sus expertos y rigurosos comentarios.