Este estudio analiza las evidencias patológicas y de imagen de resonancia magnética que definen la topografía de los craneofaringiomas y permiten una clasificación de las lesiones según el riesgo de daño hipotalámico que estas asocian.
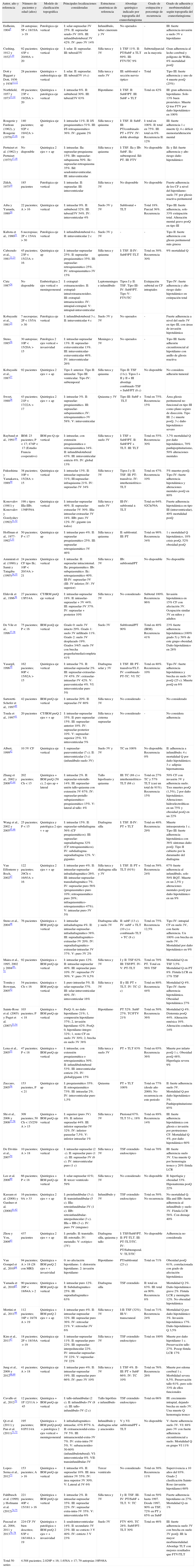
Material y métodosSe ha realizado un análisis sistemático de los métodos de clasificación topográfica empleados en las series quirúrgicas de craneofaringiomas descritas en la literatura (n=145 series, 4.588 craneofaringiomas). También se analizaron las relaciones topográficas de casos individuales intervenidos y bien descritos de la literatura (n=224 casos) y de casos estudiados en autopsias (n=201 casos). Finalmente, se analizaron y compararon los estudios prequirúrgicos y posquirúrgicos de imagen de resonancia magnética de craneofaringiomas bien descritos (n=130) para establecer un modelo diagnóstico topográfico en 3 ejes de la lesión, que permite anticipar cualitativamente el riesgo quirúrgico asociado de daño hipotalámico.
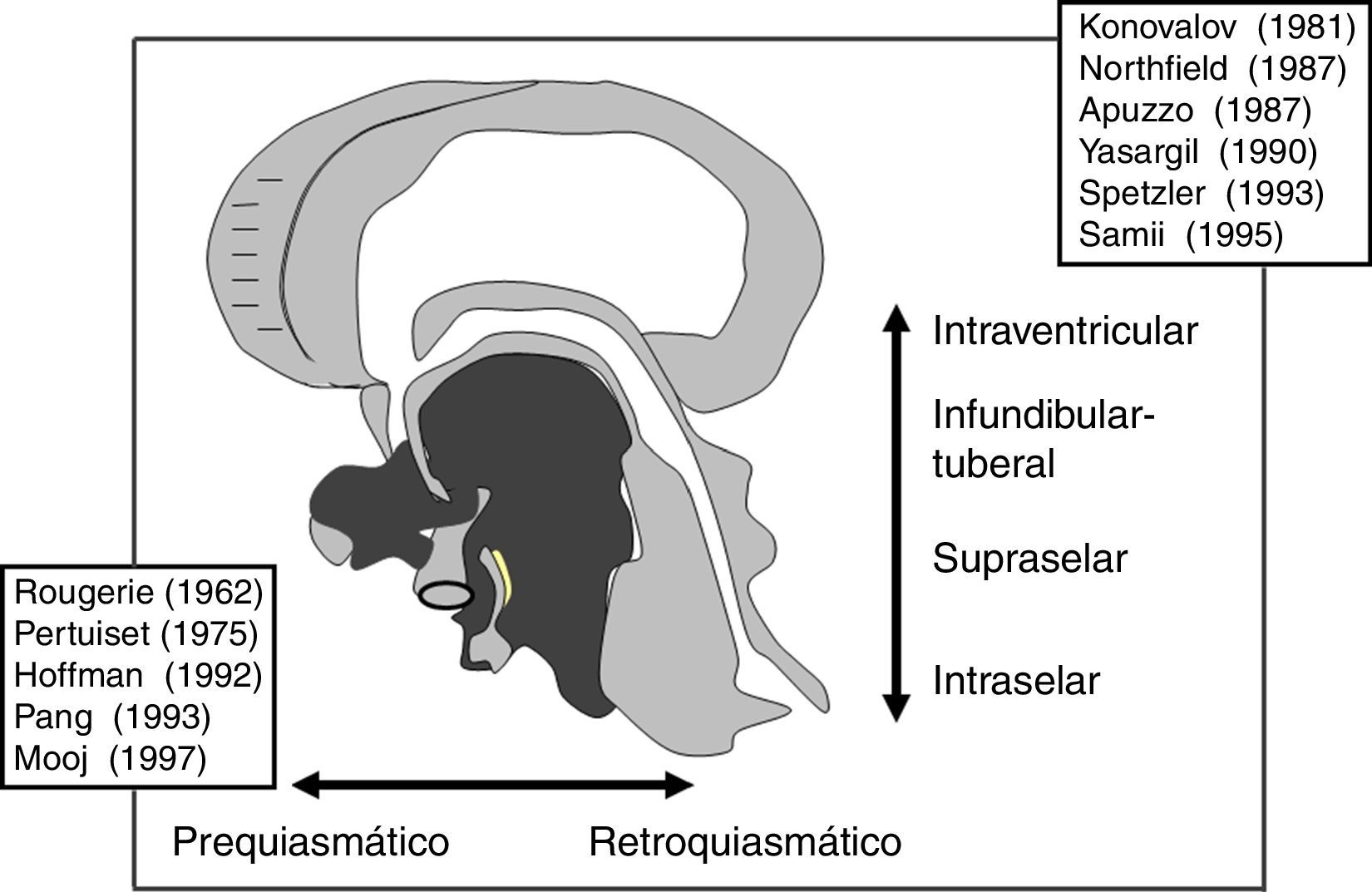
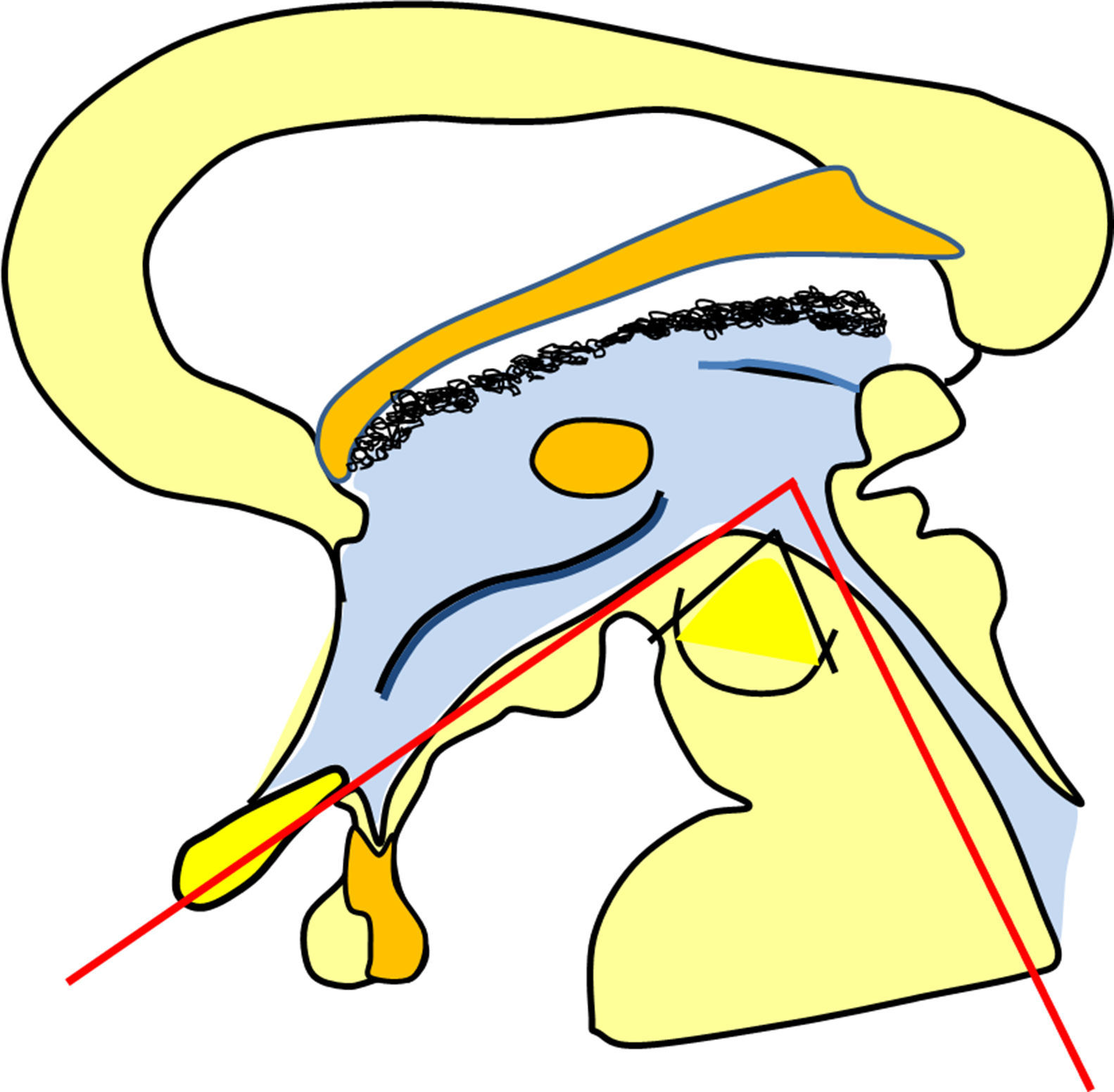
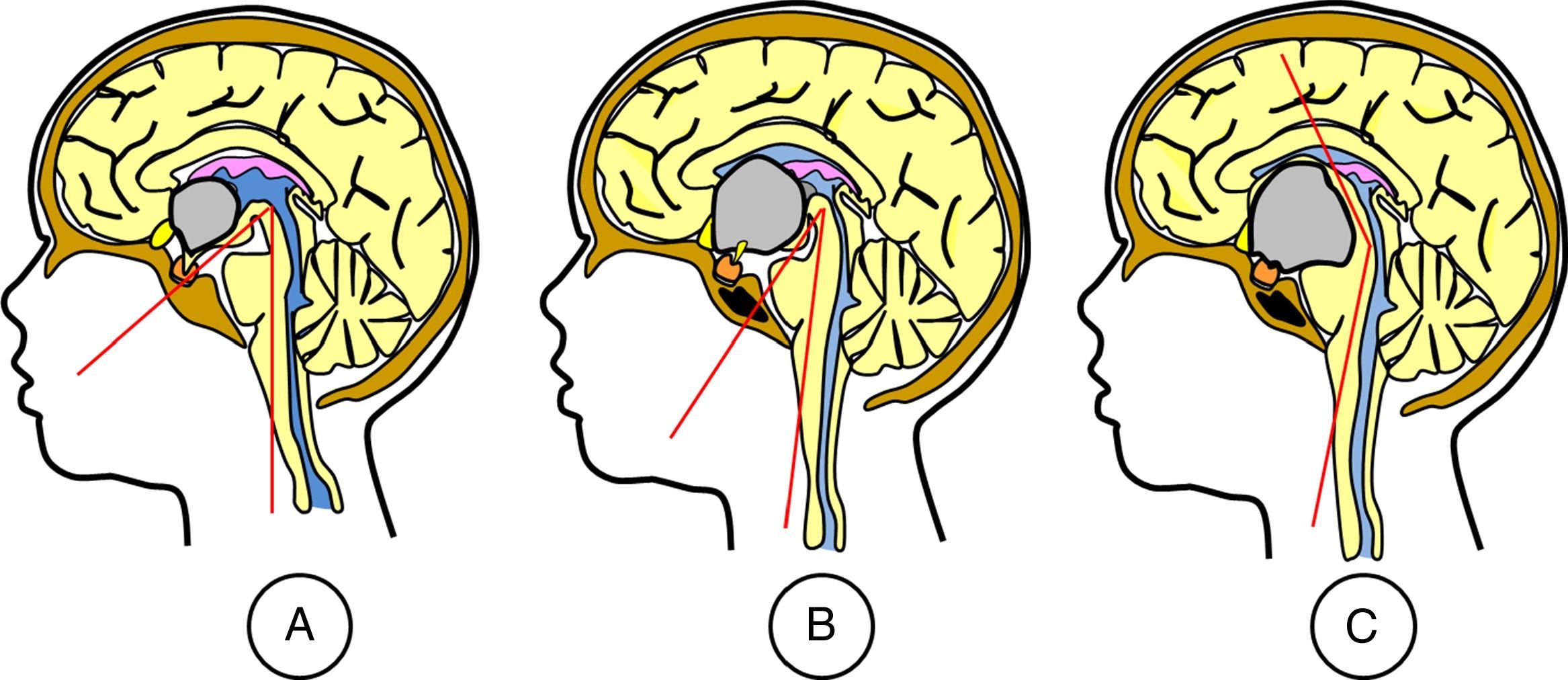
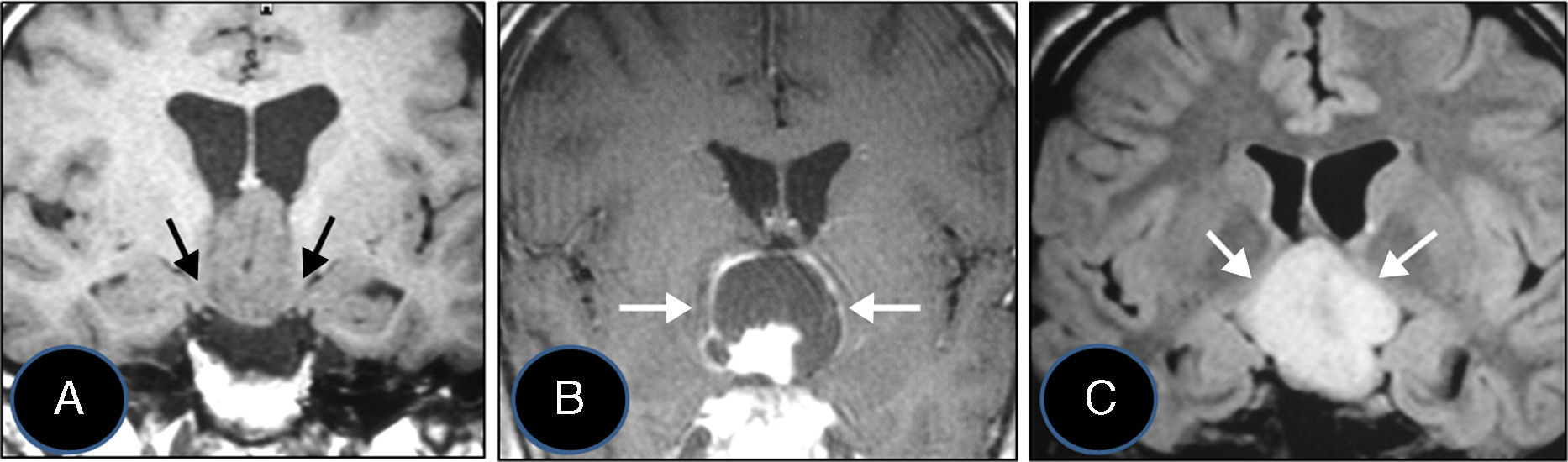
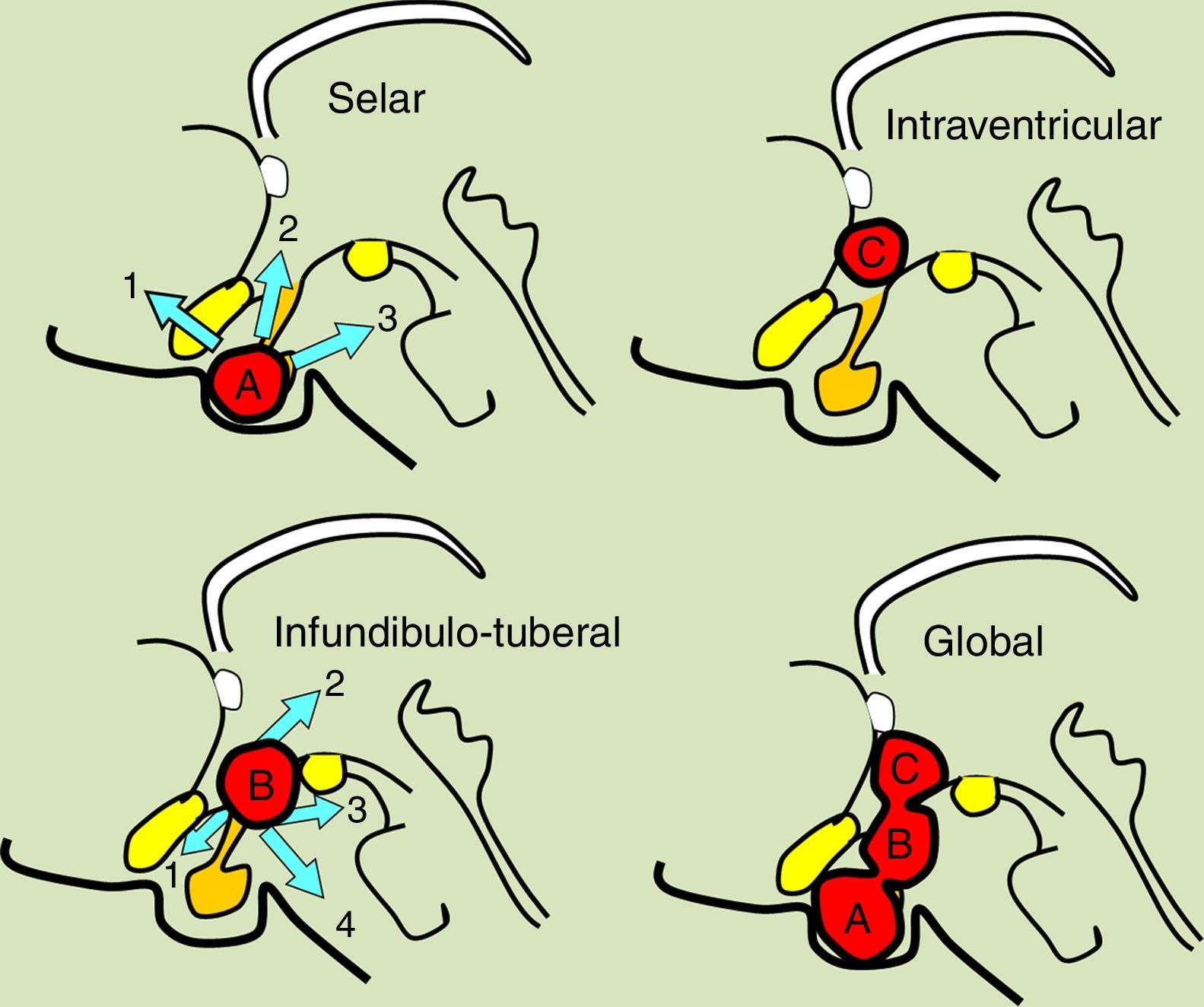
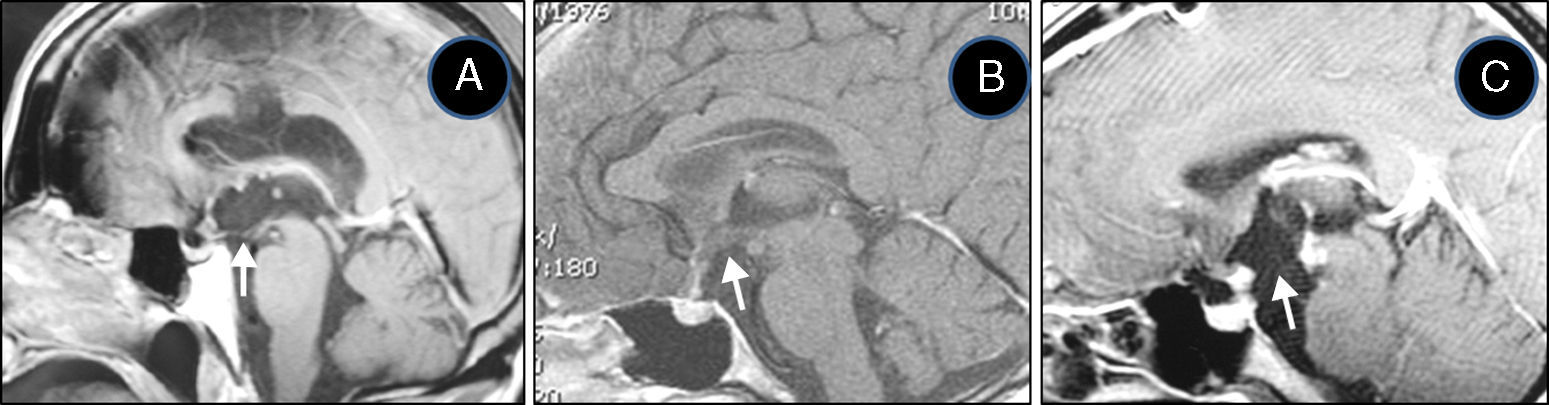
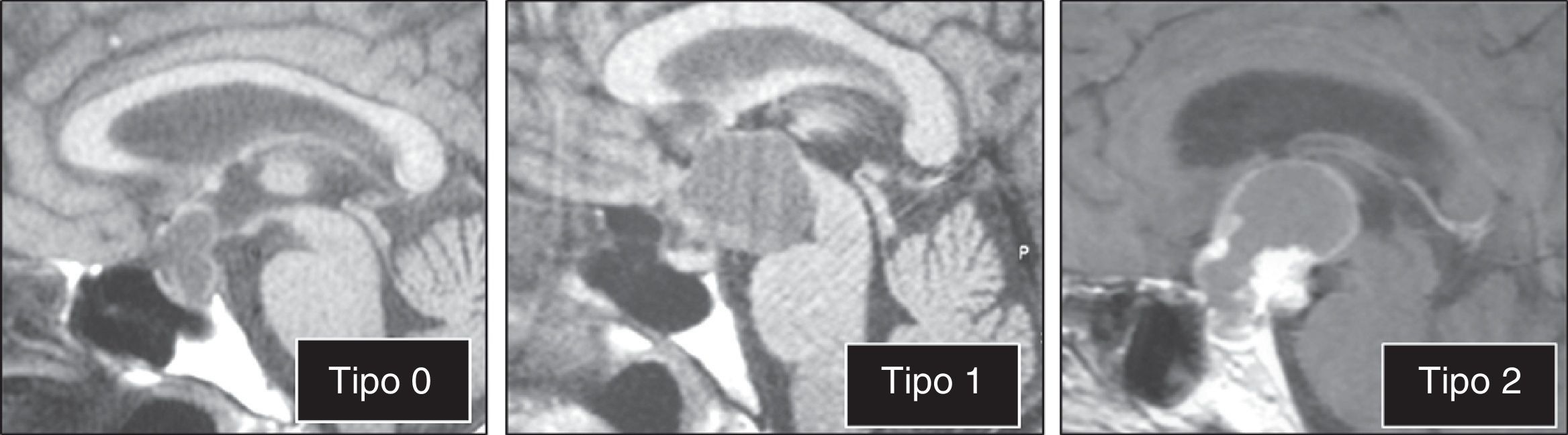
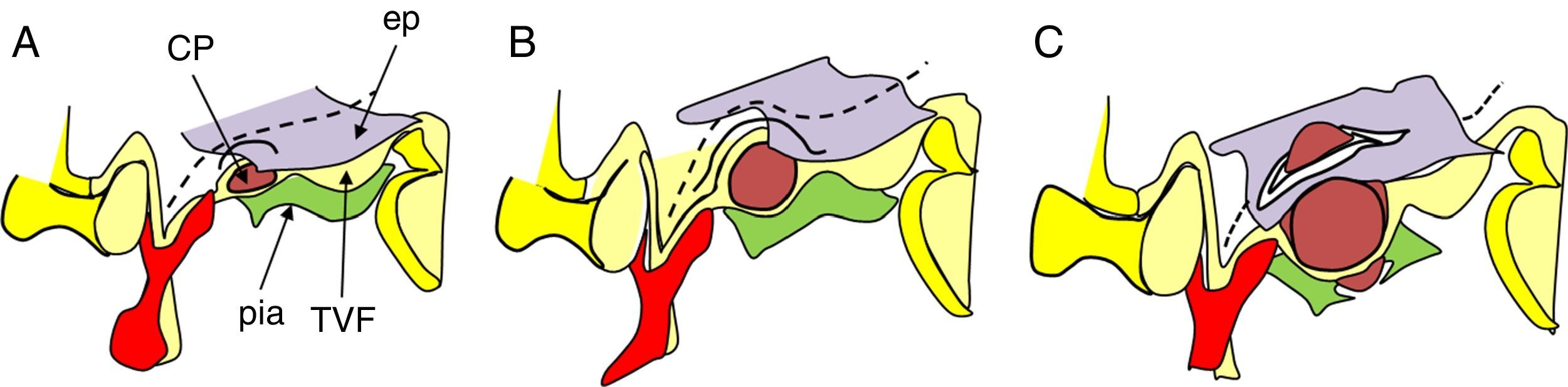
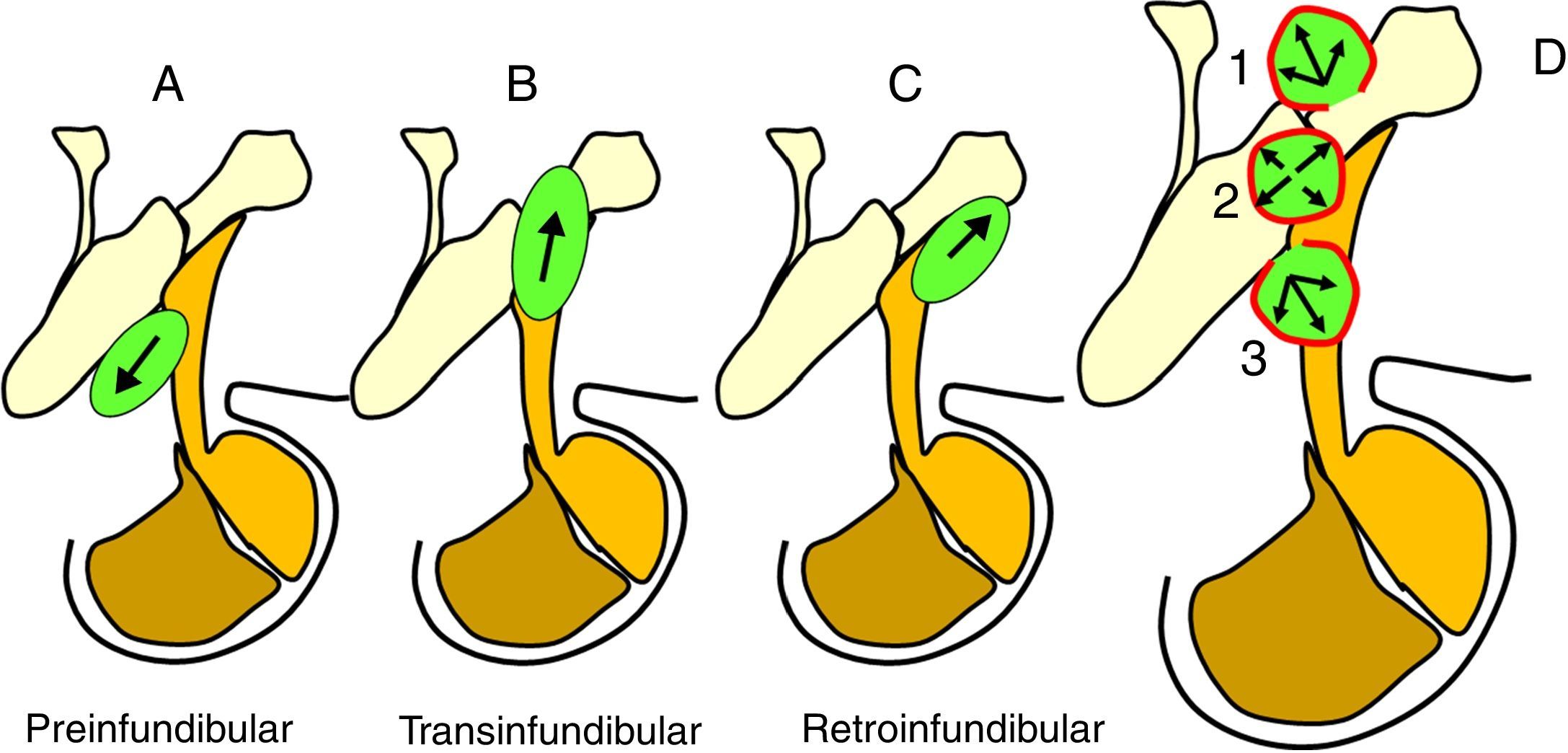
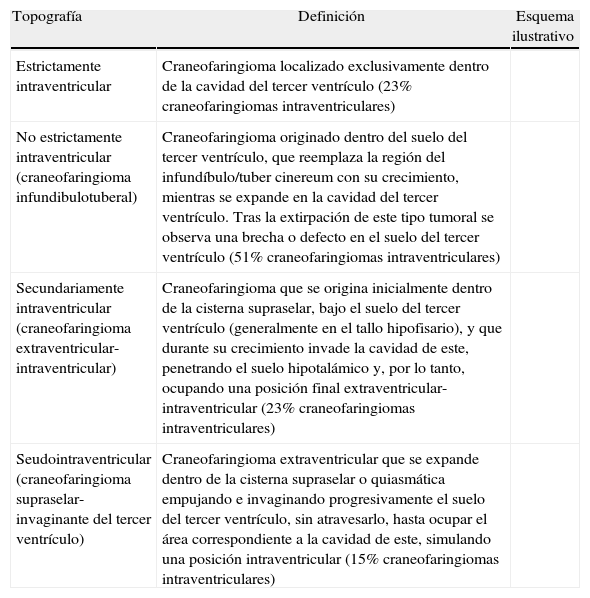
ResultadosLas 2 principales variables pronósticas que definen la topografía del craneofaringioma son su posición con respecto al diafragma selar y la afectación del suelo del tercer ventrículo. Un modelo diagnóstico de 5 variables, que son: edad del paciente, existencia de hidrocefalia o de alteraciones del comportamiento, posición relativa de los hipotálamos y el valor del ángulo mamilar, permiten diferenciar craneofaringiomas supraselares que comprimen el tercer ventrículo (craneofaringiomas seudointraventriculares) de lesiones estrictamente intraventriculares o aquellas con un crecimiento primario en el suelo del tercer ventrículo (craneofaringiomas infundibulotuberales o no estrictamente intraventriculares).
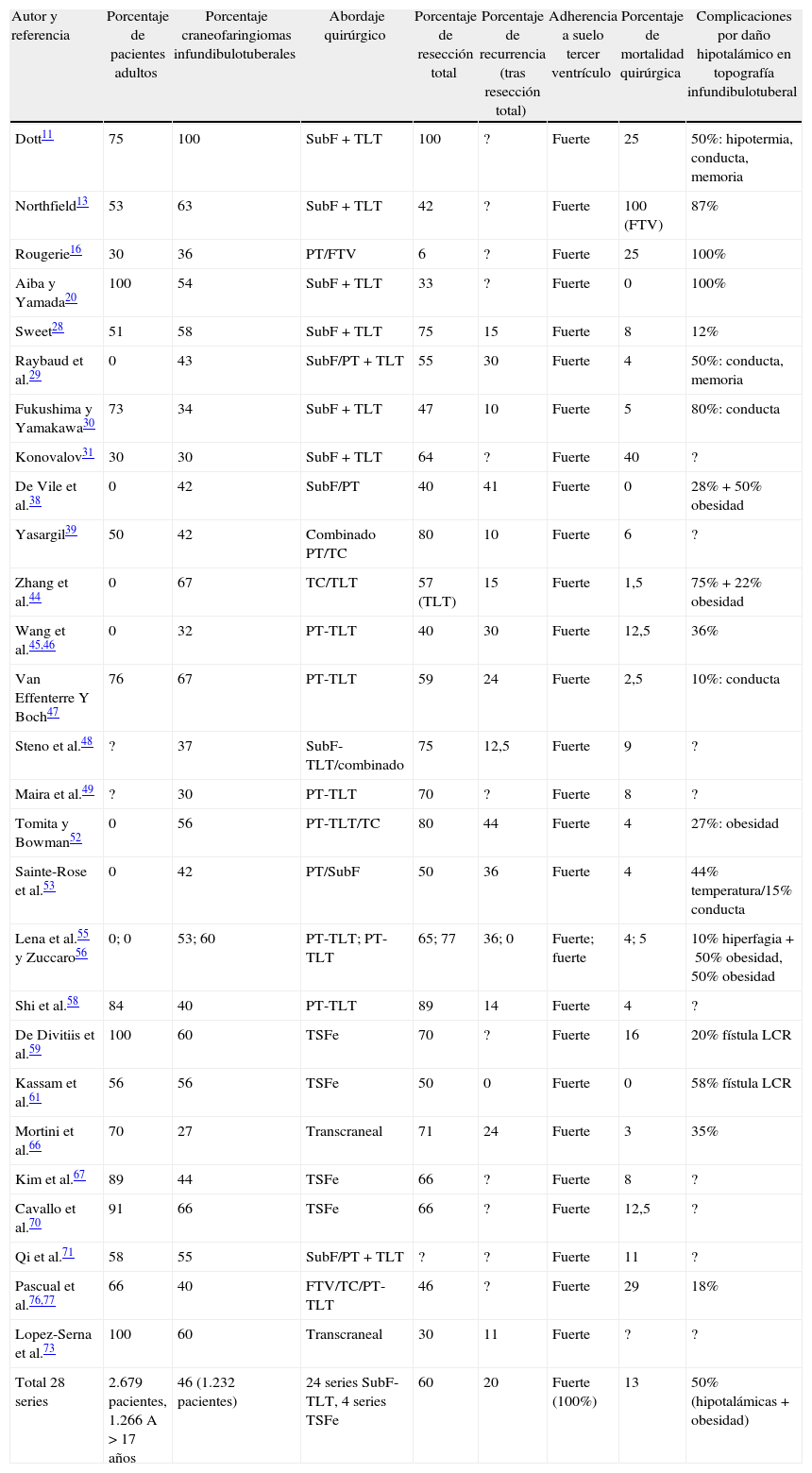
ConclusionesUn modelo de clasificación topográfica de los craneofaringiomas en 3 ejes que incluya el grado de infiltración del hipotálamo es útil para la planificación del abordaje y el grado de resección. Los craneofaringiomas infundibulotuberales representan un 42% de los casos y muestran una adherencia fuerte y circunferencial al suelo del tercer ventrículo, asociando un riesgo de daño hipotalámico del 50%. El abordaje transesfenoidal endoscópico permite valorar la adherencia tumoral hipotalámica bajo visión directa.
This study evaluates the pathological and magnetic resonance imaging evidence to define the precise topographical relationships of craniopharyngiomas and to classify these lesions according to the risks of hypothalamic injury associated with their removal.
Material and methodsAn extensive, systematic analysis of the topographical classification models used in the surgical series of craniopharyngiomas reported in the literature (n=145 series, 4,588 craniopharyngiomas) was performed. Topographical relationships of well-described operated craniopharyngiomas (n=224 cases) and of non-operated cases reported in autopsies (n=201 cases) were also analysed. Finally, preoperative and postoperative magnetic resonance imaging studies displayed in craniopharyngiomas reports (n=130) were compared to develop a triple-axis model for the topographical classification of these lesions with qualitative information regarding the associated risk of hypothalamic injury.
ResultsThe 2 major variables with prognostic value to define the topography of a craniopharyngioma are its position relative to the sellar diaphragm and its degree of invasion of the third ventricle floor. A multivariate diagnostic model including 5 variables –patient age, presence of hydrocephalus and/or psychiatric symptoms, the relative position of the hypothalamus and the mammillary body angle– makes it possible to differentiate suprasellar craniopharyngiomas displacing the third ventricle upwards (pseudointraventricular craniopharyngiomas) from either strictly intraventricular craniopharyngiomas or lesions developing primarily within the third ventricle floor (infundibulo-tuberal or not strictly intraventricular craniopharyngiomas).
ConclusionsA triple-axis topographical model for craniopharyngiomas that includes the degree of hypothalamus invasion is useful in planning the surgical approach and degree of resection. Infundibulo-tuberal craniopharyngiomas represent 42% of all cases. These lesions typically show tight, circumferential adhesion to the third ventricle floor, with their removal being associated with a 50% risk of hypothalamic injury. The endoscopically-assisted extended transsphenoidal approach provides a proper view to assess the degree and extension of craniopharyngioma adherence to the hypothalamus.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".