Evaluar los factores predictores de resangrado en los pacientes con hemorragia subaracnoidea aneurismática y tratamiento neuroquirúrgico tardío.
Pacientes y métodoSe realizó un estudio tipo cohorte prospectivo con los 261 pacientes atendidos en el Hospital Hermanos Ameijeiras en La Habana, Cuba, en el periodo comprendido entre octubre de 2005 y junio de 2014, con diagnóstico de hemorragia subaracnoidea aneurismática.
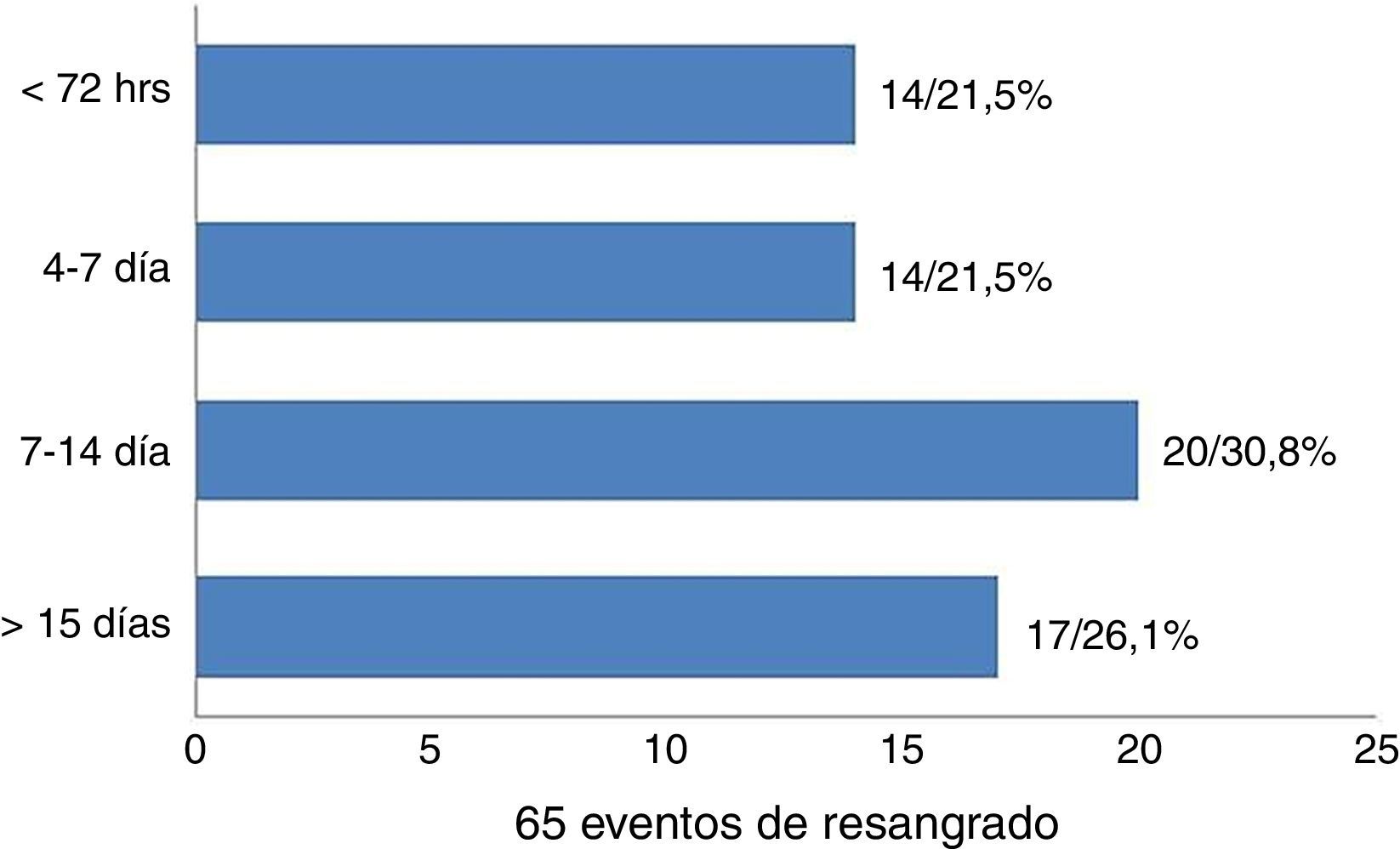
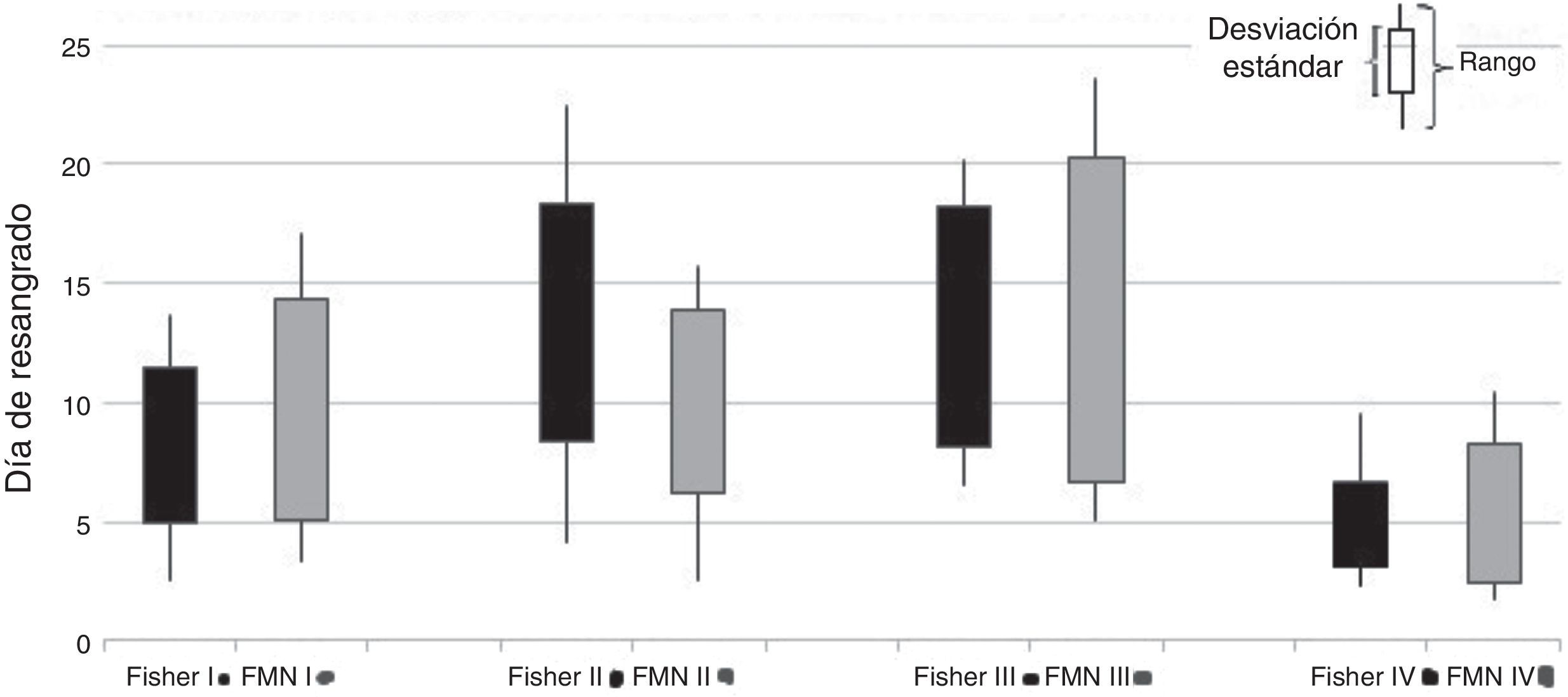
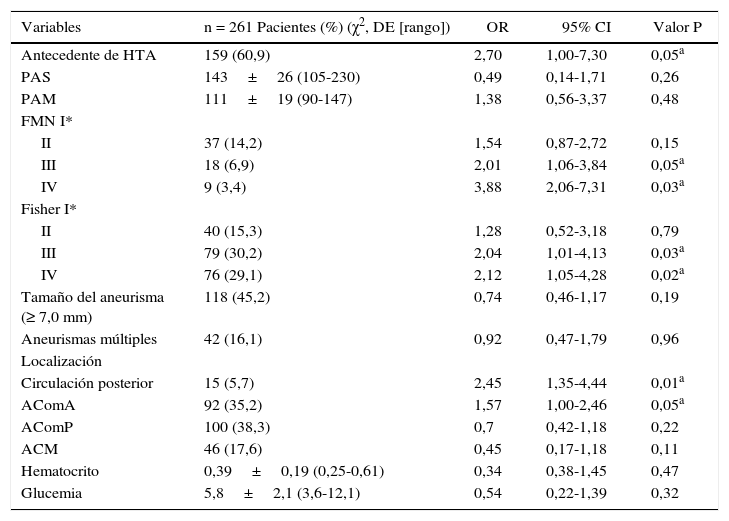
ResultadosEn el análisis multivariado se encontró que los grados III y IV de las escalas de la Federación Mundial de Neurocirujanos (III-OR 2,01; 95% CI 1,06-3,84; IV-OR 3,84, 95% CI 2,06-7,31) y de Fisher (III-OR 2,04; 95% CI 1,01-4,13; IV-OR 2,12; 95% CI 1,05-4,28), los aneurismas localizados en la arteria comunicante anterior (OR 1,57; 95% CI 1,00-2,46) y de circulación posterior (OR 2,45; 95% CI 1,33-4,44), así como el antecedente personal de hipertensión arterial (OR 2,70; 95% CI 1,00-7,30) fueron asociados a un incremento del riesgo de resangrado, mientras que la cifras de tensión arterial, las de glucemia, los aneurismas múltiples y la localización en la arteria cerebral media no mostró esta relación.
ConclusionesLos antecedentes de hipertensión arterial, los peores grados en las escalas de Fisher y de la Federación Mundial de Neurocirujanos, así como la localización de los aneurismas fueron factores de riesgo independientes de resangrado en pacientes con hemorragia subaracnoidea aneurismática y tratamiento neuroquirúrgico tardío.
To evaluate the re-bleeding predictors in patients with delayed treatment of aneurysmal subarachnoid hemorrhage.
Patients and methodsA prospective cohort study enrolled 261 patients with aneurysmal subarachnoid hemorrhage, attending in Hermanos Ameijeiras Hospital from October 2005, and June 2014.
ResultsAn increased re-bleeding risk in the multivariate analysis was associated with grade III (OR 2.01; 95% CI; 1.06-3.84) and grade IV (OR 3.84; 95% CI; 2.06-7.31) on World Federation Neurological Surgeon (WFNS) scale; grade III (OR 2.04; 95% CI; 1.01-4.13) and grade IV (OR 2.12, 95% CI; 1.05-4.28) on the Fischer scale, aneurism location in posterior circulation (OR 2.45, 95% CI; 1.33-4.44), and anterior communicant artery (OR 1.57, 95% CI;1.00-2.46). Hypertension history was present in 60.9% (159 patients) and was also associated with risk of re-bleeding (OR 2.70, 95% CI; 1.00-7.30). Blood pressure, haematocrit, glycemic, aneurysm size, multiple aneurysms, and location in the middle cerebral artery, do not show any relationship.
ConclusionHypertension history, poor grade (III and IV) on WFNS and Fisher scale and aneurysm location were independent risks factors of re-bleeding in patients with delayed aneurysmal treatment.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".