A propósito de un caso de estesioneuroblastoma, nuestros objetivos son mostrar que los abordajes endonasales expandidos (AEE) pueden ser una técnica quirúrgica segura y eficaz para la resección de neoplasias malignas de la base del cráneo anterior y realizar una revisión bibliográfica de la literatura inglesa disponible a este respecto.
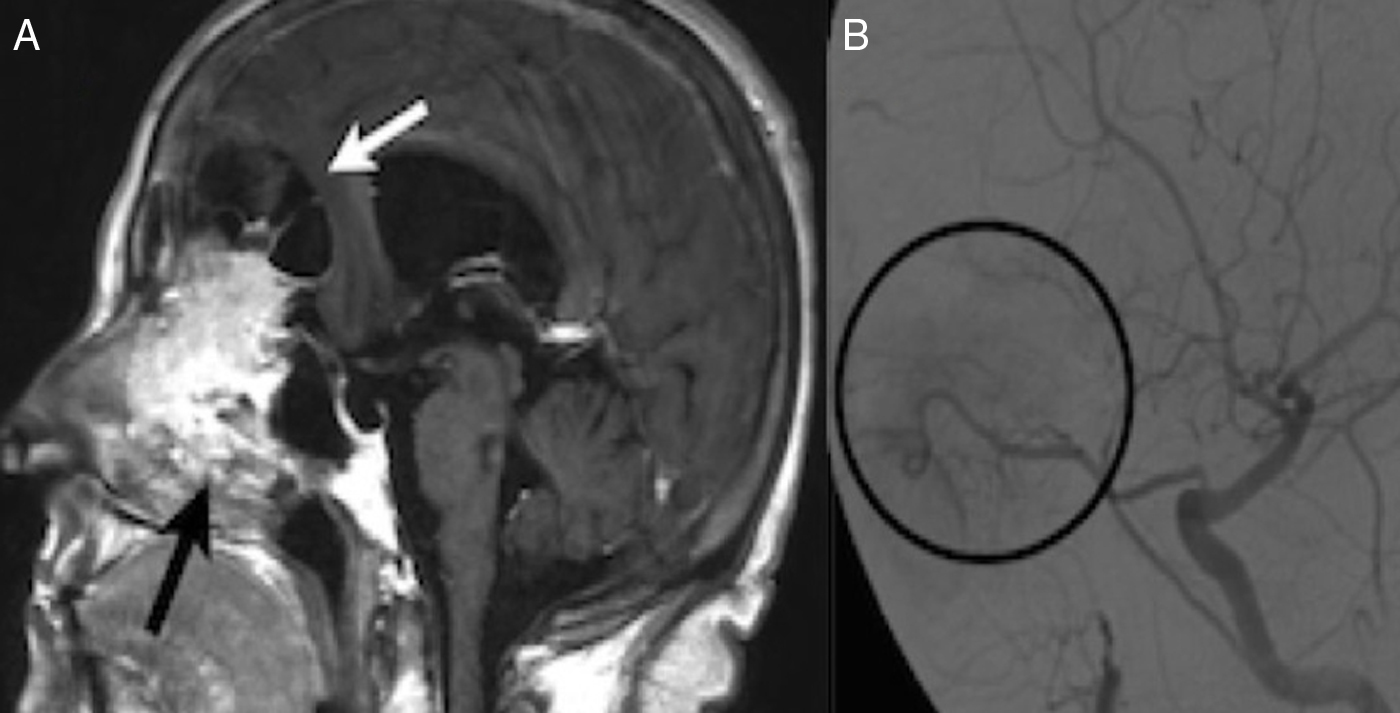
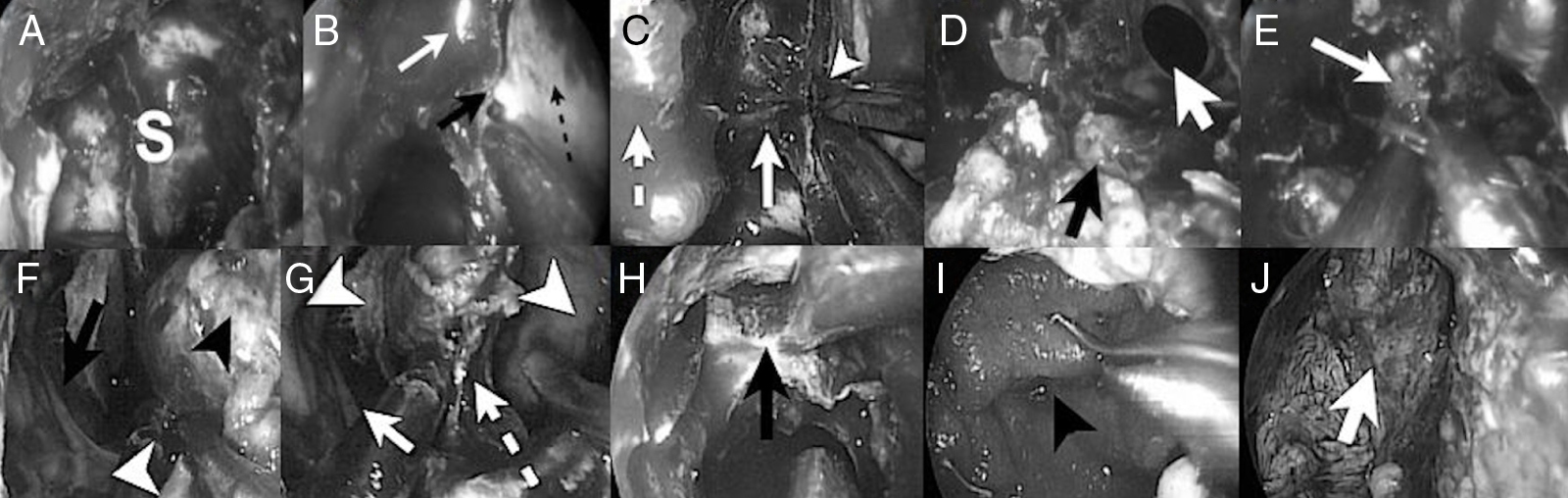
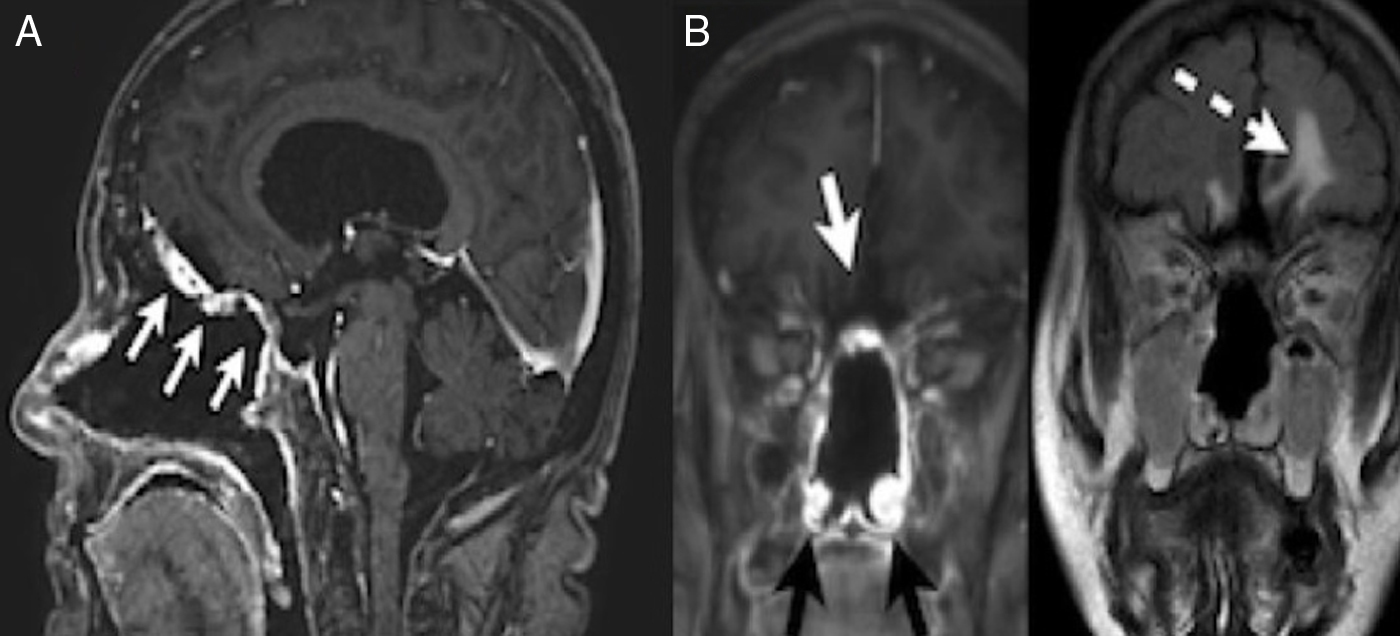
Caso clínicoPaciente mujer de 65 años con historia de anosmia y deterioro cognitivo. Las pruebas de imagen evidencian una gran tumoración que afecta a la cavidad nasal y compromete la base del cráneo anterior, sugestiva de tumor nasosinusal maligno con afectación intracraneal. Se realiza un abordaje endonasal expandido transcribiforme-transfovea etmoidalis consiguiendo una resección completa con márgenes libres de enfermedad. El tratamiento se complementó con radioterapia.
DiscusiónLa resección craneofacial clásica consigue la exéresis de las patologías nasosinusales malignas, incluso cuando involucran la cavidad intracraneal, a la vez de permitir la reconstrucción de la base craneal, independizando el espacio subaracnoideo. El avance de las nuevas técnicas endoscópicas ha permitido conseguir resultados oncológicos comparables y capacidad reconstructiva suficiente, conllevando menor morbilidad y mejor tolerancia por parte del paciente.
ConclusiónLos AEE a la base del cráneo anterior podrían establecerse en el futuro inmediato como el tratamiento de primera elección, siempre y cuando los márgenes exigidos por la resección estén comprendidos en los límites anatómicos alcanzables a través de dichos abordajes.
We report a fully endoscopic transcribiform-transfovea ethmoidalis endonasal expanded approach (EEA) for the treatment of esthesioneuroblastoma and review the literature about this entity available in English, establishing a precise surgical technique and describing our intraoperative experience.
Case reportOur patient was a 65-year old female with anosmia and cognitive deterioration. Cranial MRI showed a large tumoral lesion with solid and cystic components involving the nasal cavity, with diagnostic suspicion of intracranial malignant sinonasal tumour. The patient underwent a fully endoscopic transcribiform-transfovea ethmoidalis EEA, achieving total resection and tumour-free margins. Surgery was followed by radiotherapy.
DiscussionCraniofacial resection enables total removal of sinonasal malignancies, even when the intracranial cavity is involved, and allows for subarachnoid space isolation from the nasal cavity. New advances in endoscopic skull base surgery have achieved comparable oncological results and sufficient reconstructive capacity, leading to less morbidity and better tolerance.
ConclusionEEA may become the first treatment option for skull base malignancies in an immediate future, provided that the anatomical limits of the extended approach are not exceeded by the lesion.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".