Realizar una revisión de los pacientes en edad infantil con tumores de plexos coroideos (TPC) intervenidos en el Hospital Infantil Niño Jesús de Madrid desde enero de 1981 hasta septiembre de 2014.
Material y métodoLos casos registrados fueron analizados en base a la epidemiología, el grado tumoral, las características clínicas, la localización, las características de la diseminación, la actitud terapéutica, el pronóstico y las complicaciones.
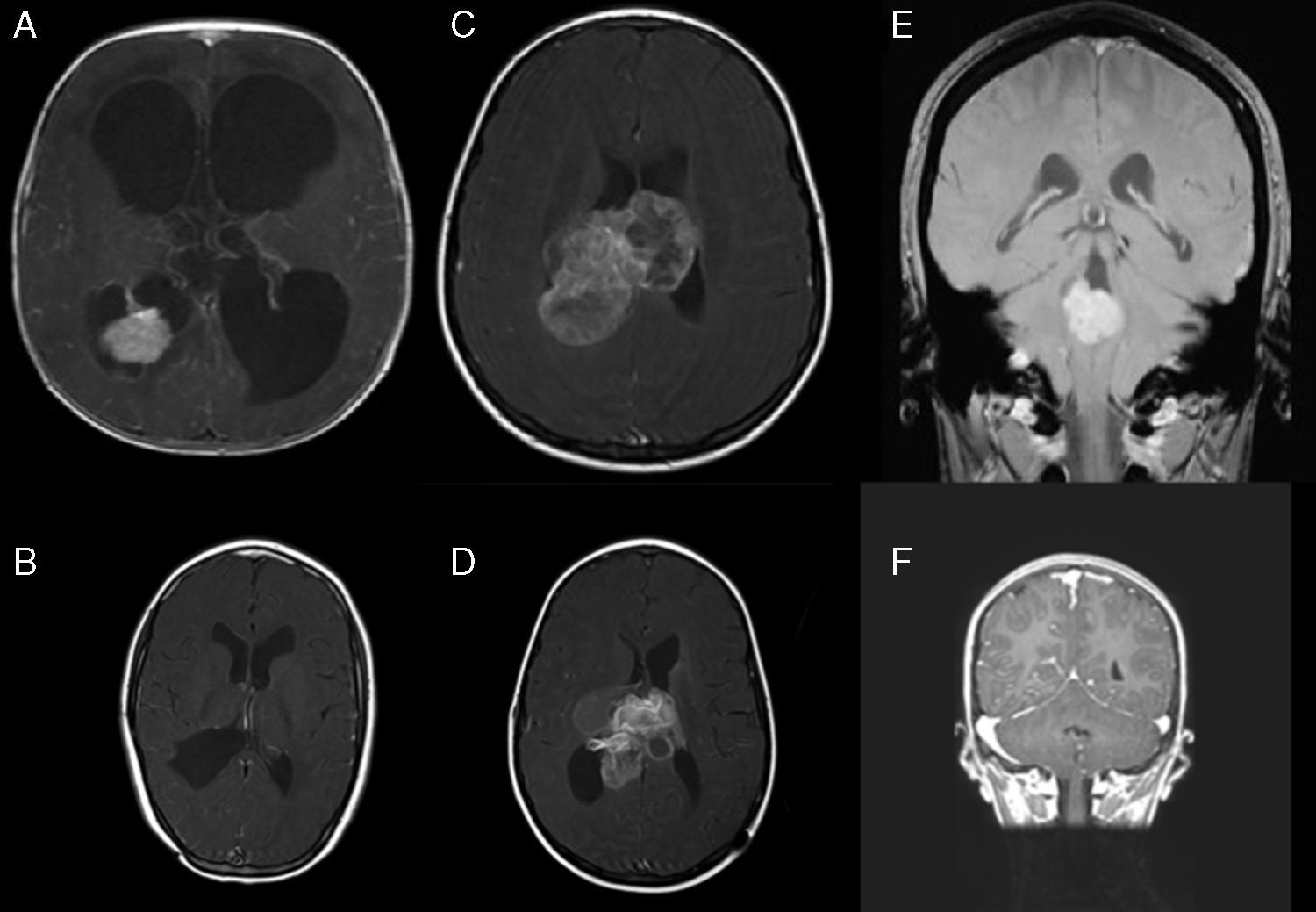
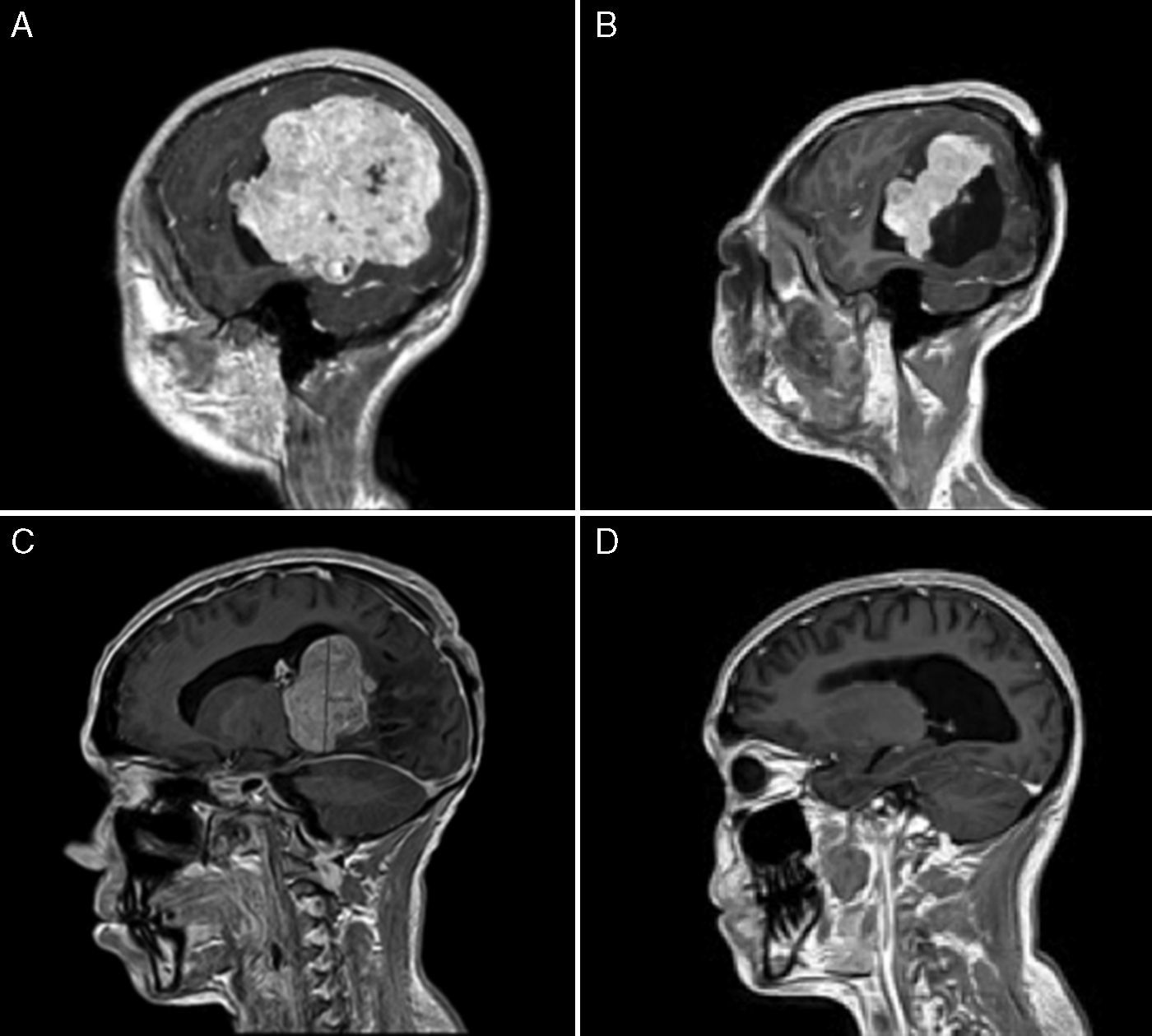
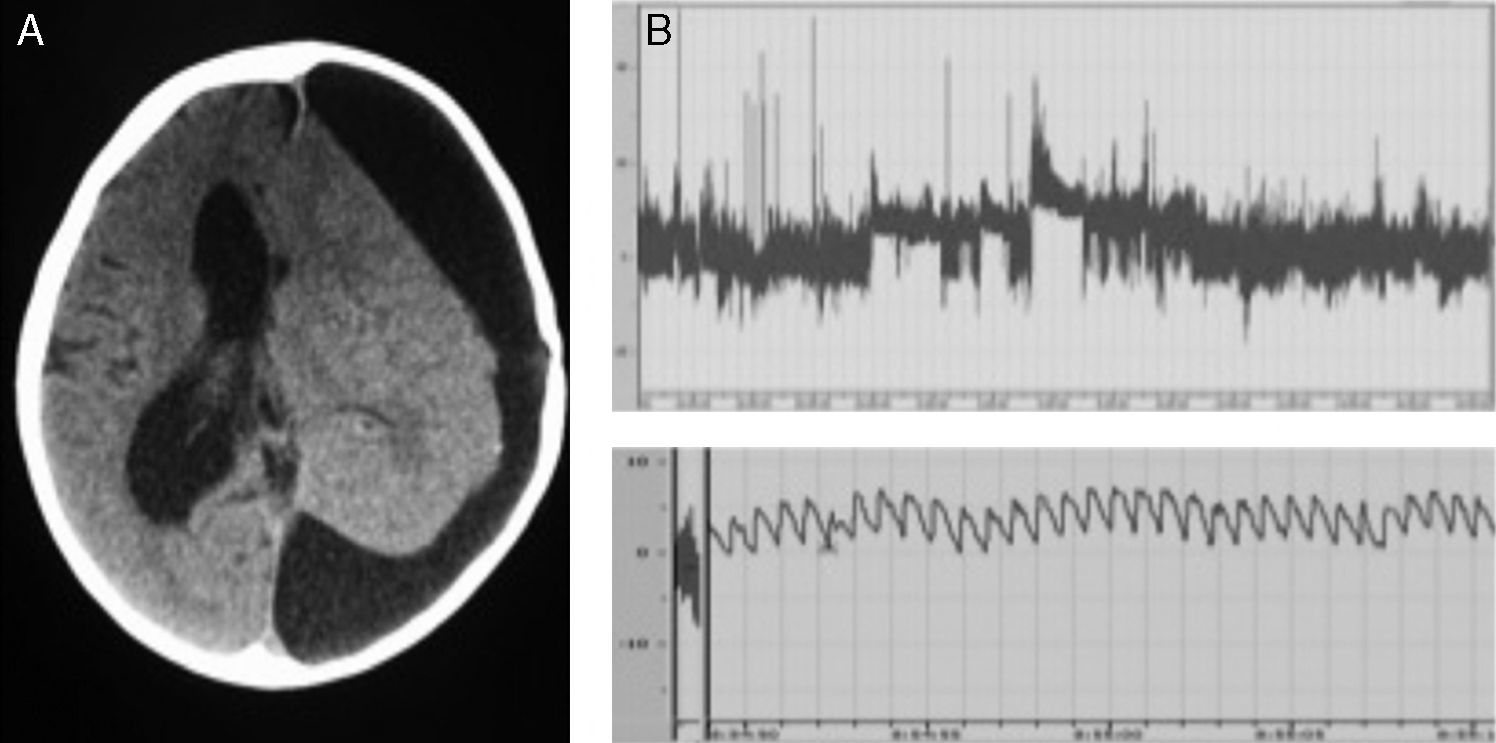
ResultadosSe registraron 17 pacientes con TPC en edad infantil. Los casos se distribuyeron de modo que 9 casos fueron diagnosticados como papiloma de plexos coroideos (PPC) (52,9%), 2 casos como PPC atípicos (11,7%) y 6 casos como carcinoma de plexos coroideos (CPC) (35,2%). La edad al diagnóstico fue menor de 2 años en 14 de los 17 pacientes (82,3%) y la incidencia fue mayor en los varones (82,3% de los casos). Se realizó resección completa en 16 pacientes (94,1%). Recibieron tratamiento complementario 6 pacientes (todos diagnosticados de CPC) (35,2%). Dos de los 17 pacientes fallecieron (11,7%), mostrando una densidad de incidencia de 0,01 muertes/año.
ConclusionesNuestra serie de casos es concordante con series previas publicadas en la literatura científica en cuanto a epidemiología, grado tumoral, presentación clínica, características radiológicas y actitud terapéutica. El patrón oro en el tratamiento de los TPC es la resección quirúrgica completa. La quimioterapia y radioterapia deben reservarse para el tratamiento complementario de CPC y recidiva o resto tumoral de PPC atípico.
To review childhood patients with choroid plexus tumors (CPT) who underwent surgery at Hospital Infantil Niño Jesús of Madrid since January 1981 to September 2014.
Material and methodsRegistered charts were analyzed based on the epidemiology, tumor grade, clinical profile, location, dissemination characteristics, therapy, prognosis and complications.
ResultsSeventeen childhood patients were recorded with CPT. Cases were distributed so that 9 cases were choroid plexus-papilloma (CPP) (52.9%), 2 cases atypical CPP (11.7%) and 6 cases choroid plexus-carcinoma (CPC) (35.2%). Age at diagnosis was less than 2 years in 14 of the 17 patients (82.3%) and the incidence was higher in males (82.3% of the cases). Gross total resection was performed in 16 patients (94.1%). Adjuvant treatment was used in 6 patients (all this cases with CPC) (35.2%). Two of the 17 patients died (11.7%), showing an incidence density of 0.01 deaths/year.
ConclusionsOur case series is consistent with previous published in scientific literature regarding epidemiology, tumor grade, clinical presentation, radiological features and therapeutic approach. Gross total resection is considered the therapeutic gold standard for choroid plexus tumors. Chemotherapy and radiotherapy should be used as adjuvant treatment in CPC and recurrent or remaining atypical CPP.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".