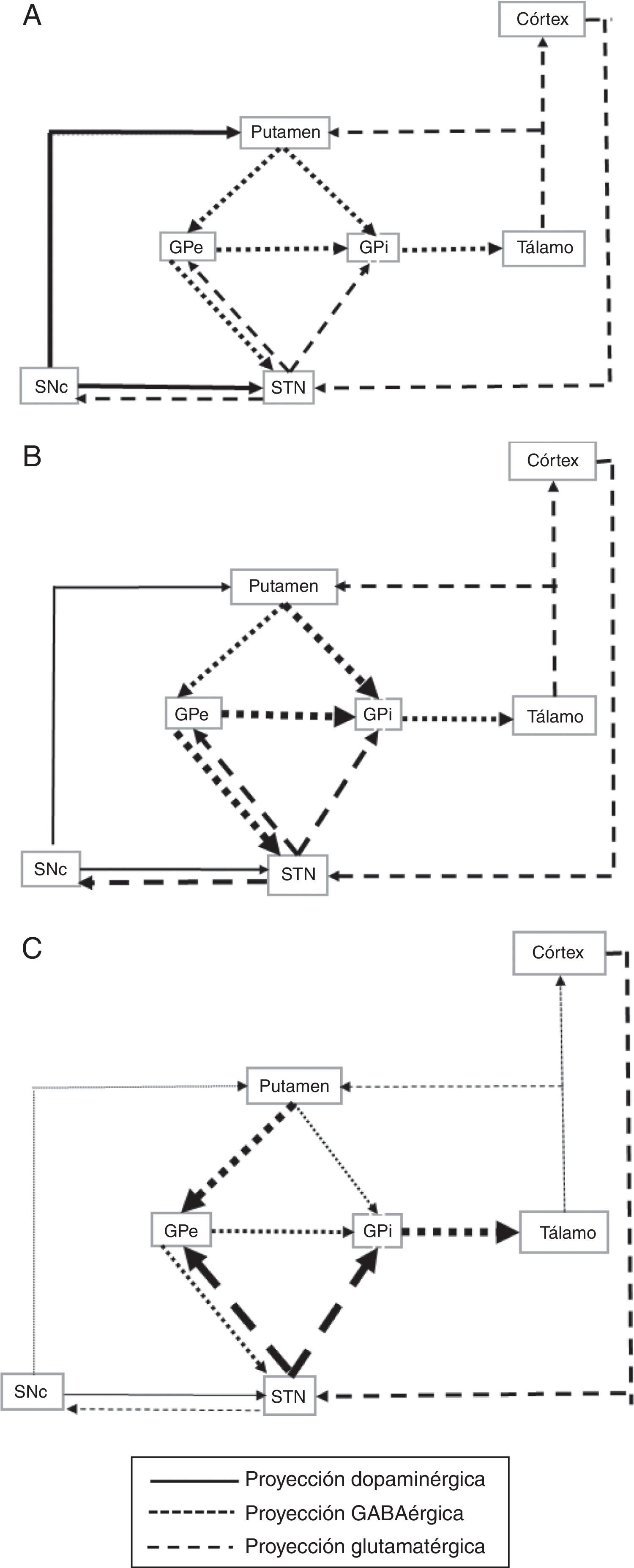
La hiperactividad del núcleo subtalámico en la enfermedad de Parkinson puede ser un fenómeno temprano. El comienzo de la misma no se conoce con exactitud pero podría ocurrir en la fase presintomática de la enfermedad. Esta hiperactividad glutamatérgica puede ser tóxica para las neuronas dopaminérgicas de la sustancia negra compacta. Si esto fuera así, el neurotransmisor excitador, ácido glutámico, afectaría a las neuronas que se encuentran con un turnover elevado como mecanismo compensador. ¿Podría una lesión en el núcleo subtalámico reducir esta hiperactividad y ser un mecanismo neuroprotector para dichas neuronas? Los autores hipotetizan sobre la posibilidad de realizar una cirugía sobre la lesión en el núcleo subtalámico en una fase muy temprana para evitar el efecto neurotóxico del ácido glutámico sobre las neuronas dopaminérgicas y ser una cirugía neuroprotectora que pudiera alterar la historia natural de la enfermedad en sus primeras fases motoras. En este sentido, los ultrasonidos guiados por resonancia abren una nueva ventana en el arsenal estereotáctico.
Subthalamic nucleus hyperactivity in Parkinson's disease may be a very early phenomenon. Its start is not well known, and it may occur during the pre-symptomatic disease stage. Glutamatergic hyperactivity may be neurotoxic over the substantia nigra compacta dopaminergic neurons. If this occurred, the excitatory neurotransmitter, glutamate, should affect the neurons that maintain a high turnover as a compensatory mechanism. Would a subthalamic nucleus lesion decrease this hyperactivity and thus be considered as a neuroprotective mechanism for dopaminergic neurons? The authors hypothesise about the possibility to perform surgery on a subthalamic nucleus lesion at a very early stage in order to avoid the neurotoxic glutamatergic effect over the dopaminergic neurons, and therefore be considered as a neuroprotective surgery able to alter the progress of the disease during early motor symptoms. In this regard, magnetic resonance-guided focused ultrasound techniques open a new window in the stereotactic armamentarium.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".