Los schwannomas vestibulares (SV) son tumores intracraneanos benignos, cuyo manejo actual es materia de debate, aunque el tratamiento microquirúrgico sigue siendo la modalidad de elección en la mayoría de los casos.
ObjetivoDescribir los resultados quirúrgicos de SV operados en un hospital público chileno.
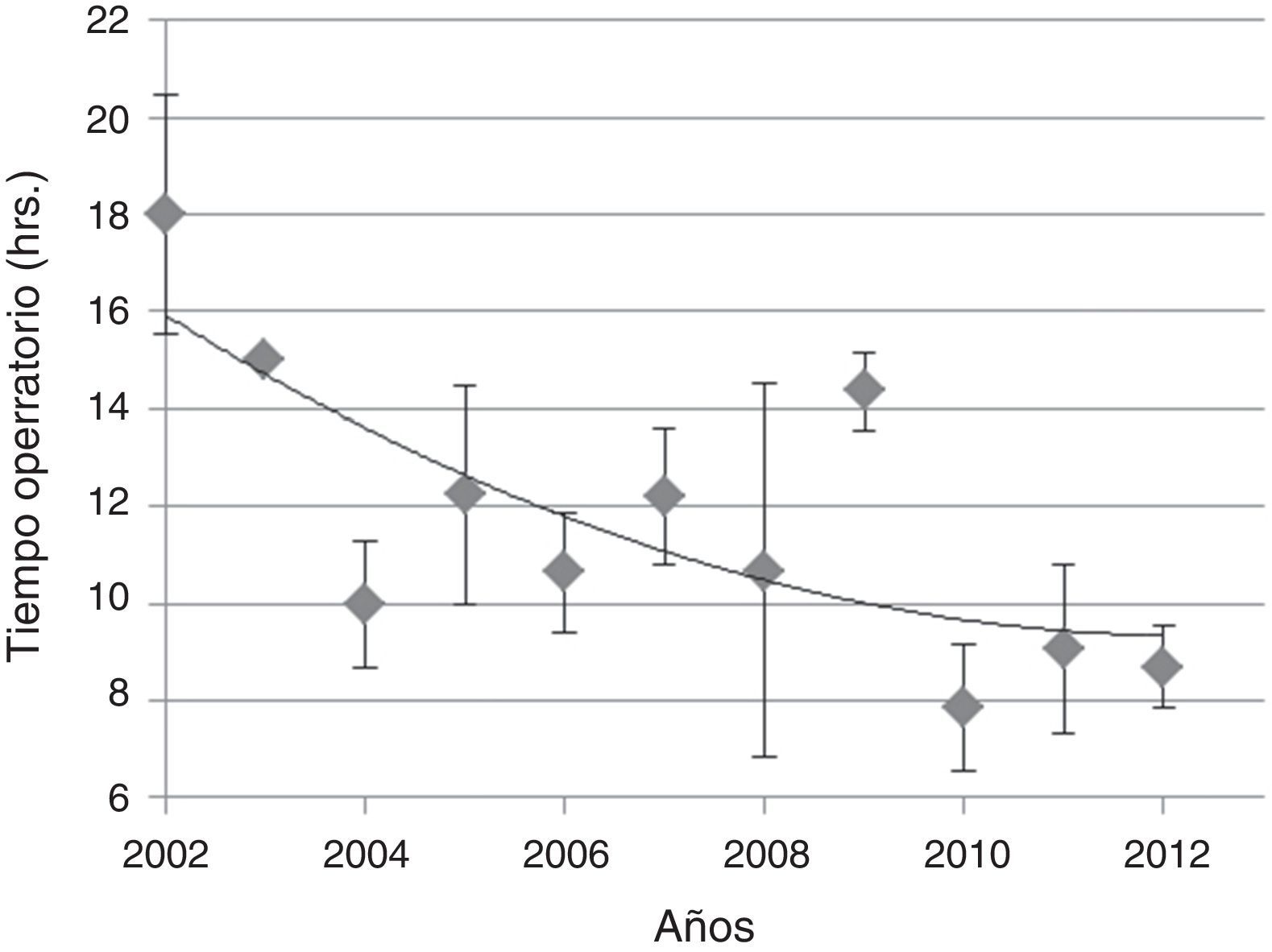
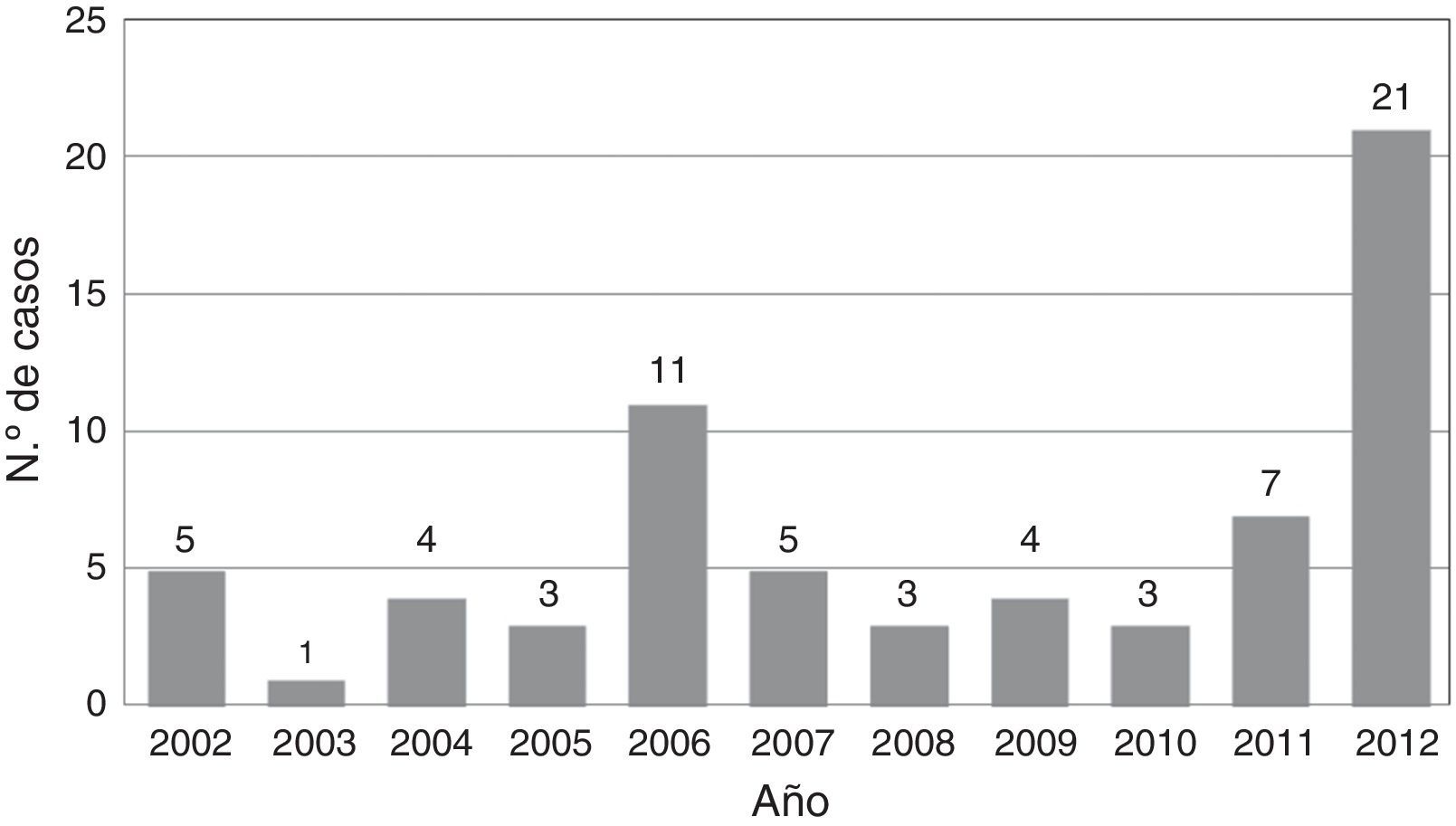
Material y métodoSe presenta una serie de 67 pacientes tratados quirúrgicamente entre los años 2002 y 2012, en el Instituto de Neurocirugía Asenjo.
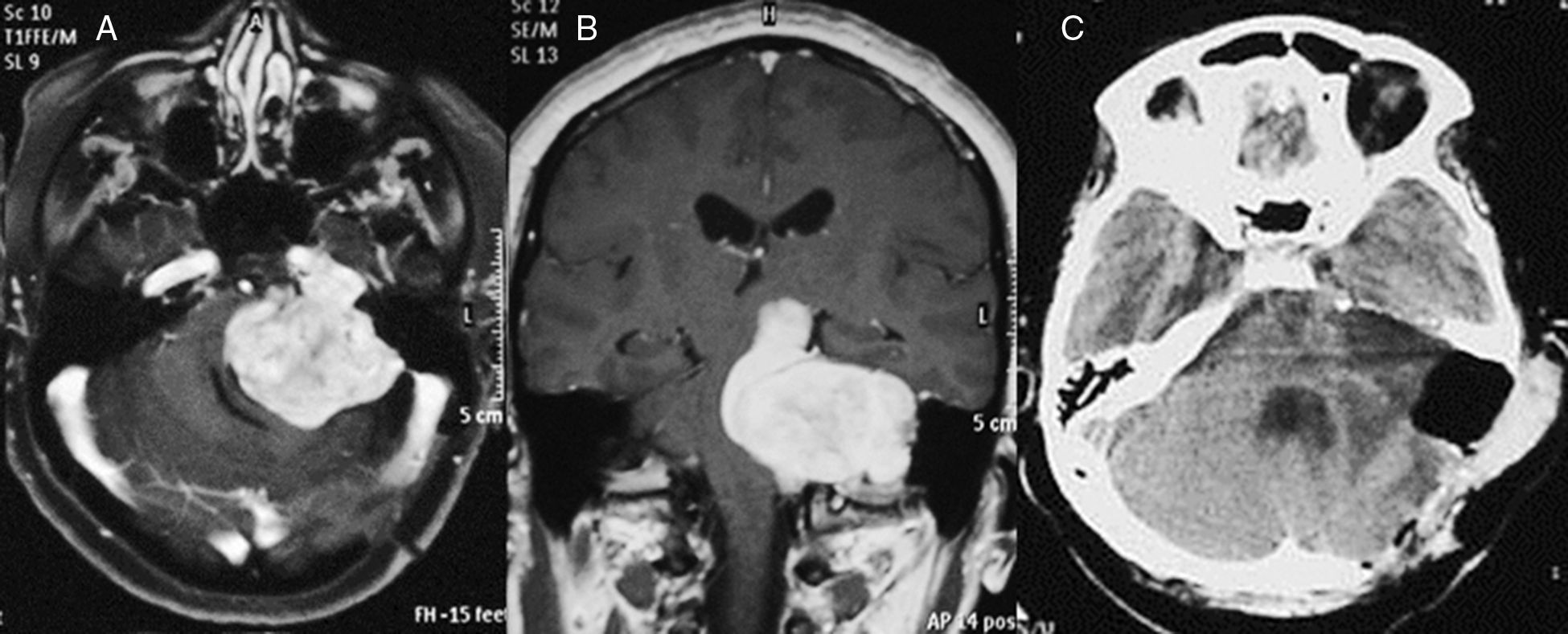
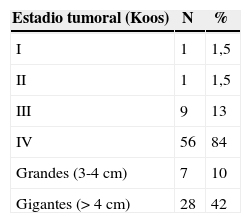
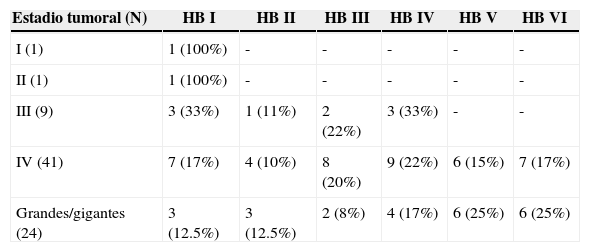
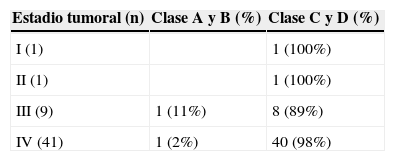
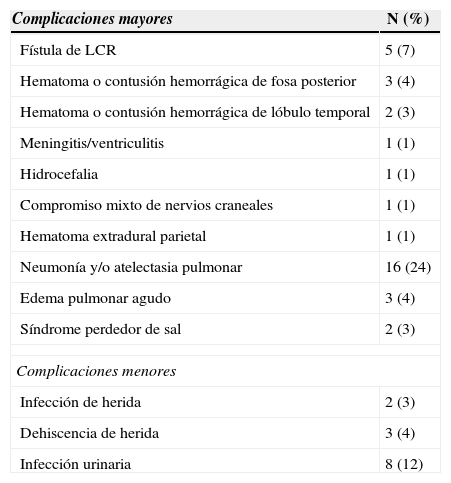
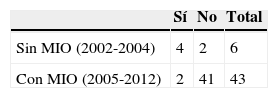
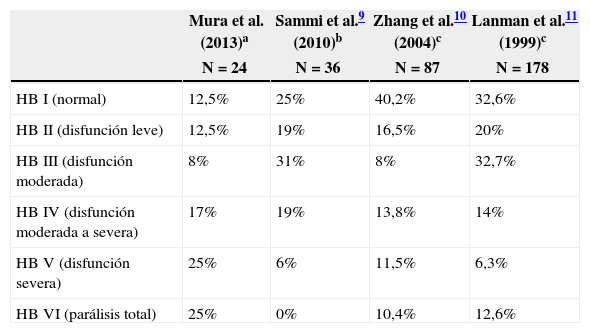
ResultadosSesenta y cinco casos (97%), correspondieron a tumores Koos III y iv, de los cuales el 52% fueron grandes (3-4cm) o gigantes (>4cm). Se realizó acceso retrosigmoideo transmeatal en 41 casos (61%). Se logró exéresis total en el 97% y subtotal en el 3% de los casos. A los 6 meses de seguimiento promedio se obtuvo buena función facial (House-Brackmann I o ii) en el 32,7% de los casos y función moderada (House-Brackmann III o iv) en el 42,3%. Las complicaciones cardiopulmonares fueron las más frecuentes (28%) y la mortalidad fue de 1,5%.
ConclusionesLos SV son tumores que pese a su naturaleza benigna pueden causar deterioro clínico significativo en estadios avanzados. Su tratamiento quirúrgico reviste gran complejidad, por lo que este debe ser realizado por equipos especializados para asegurar resultados funcionales óptimos.
Vestibular Schwannomas (VS) are benign intracranial tumors, for which their current management is a matter of debate, although microsurgical treatment remains the mode of choice in the majority of cases.
ObjectiveTo describe the surgical outcome of patients operated on for a VS in a Chilean Public Hospital.
Material and methodA series of 67 patients treated surgically between 2002 and 2012, in the Institute of Neurosurgery Asenjo is presented.
ResultsSixty-five cases (97%) corresponded to Koos III and IV tumors, of which 52% were large (3-4cm) or Giant (> 4cm). Forty-one cases were operated on using a retrosigmoid transmeatalapproach (61%). Total resection was achieved in 97% of the cases and subtotal in the remaining 3%. A mean six months follow-up showed that good facial function (House - Brackmann I or II) was obtained in 32.7% of the patients, and moderate function (House - Brackmann III or IV) in 42.3%. Cardiopulmonary complications were the most frequent (28%), and mortality was 1.5%.
ConclusionsThe VS are tumors that can cause significant neurological deficit in advanced stages, despite their benign nature. Surgical treatment is very complex, and must be performed by specialized teams to ensure optimal functional results.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".