El traumatismo craneoencefálico (TCE) grave representa una de las principales causas de incapacidad y muerte en la población pediátrica de todo el mundo. La neuromonitorización multimodal en estos pacientes en Cuba no se encuentra generalizada en las unidades de cuidados intensivos pediátricos y no existe un protocolo de actuación estandarizado para su uso en estas unidades.
Material y métodosSe realizó un estudio longitudinal prospectivo de tipo correlacional, con enfermos pediátricos que presentaron el diagnóstico de TCE grave, en el período entre enero del 2003 y diciembre del 2014. Se realizó neuromonitorización continua de parámetros como la presión intracraneal y la presión de perfusión cerebral.
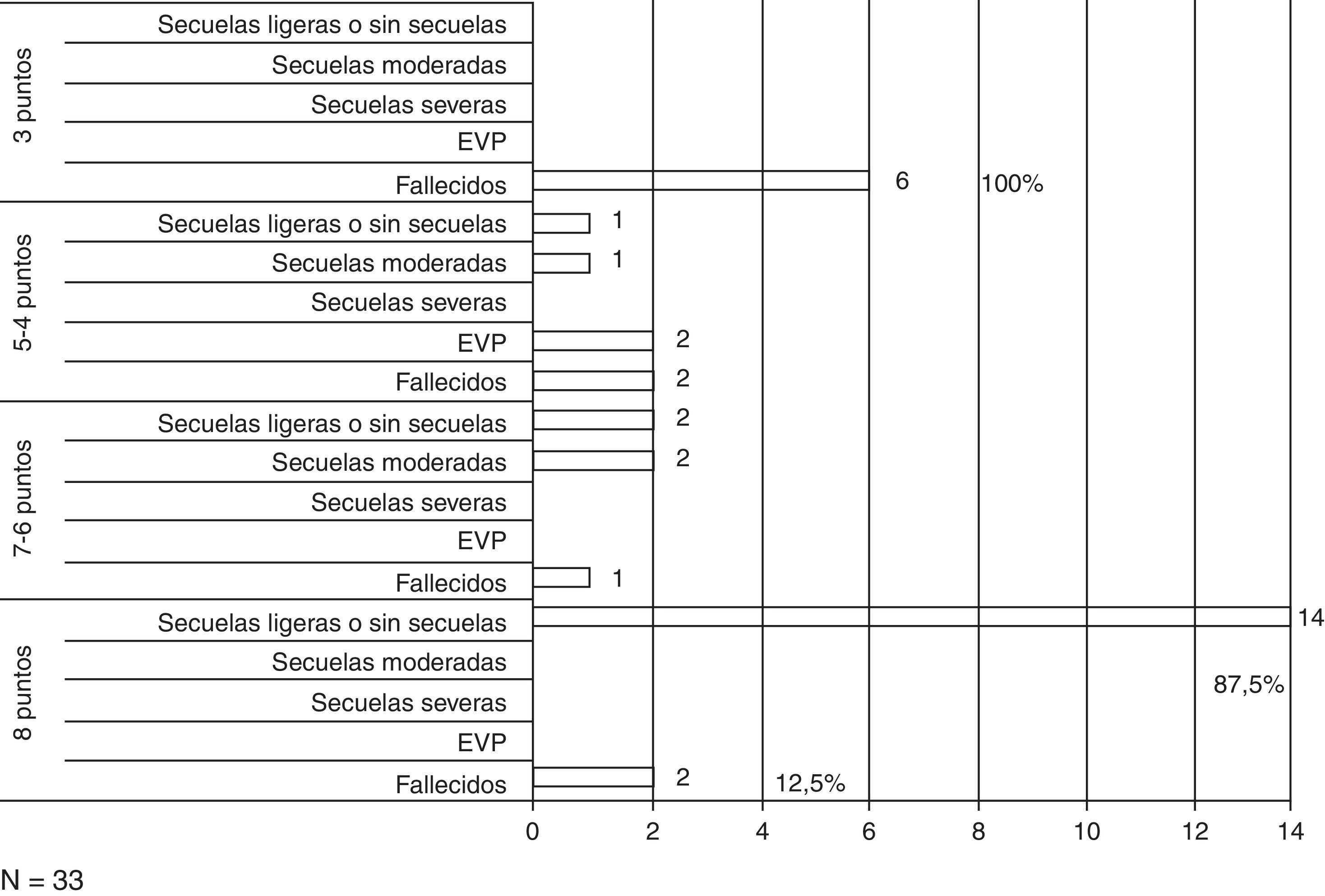
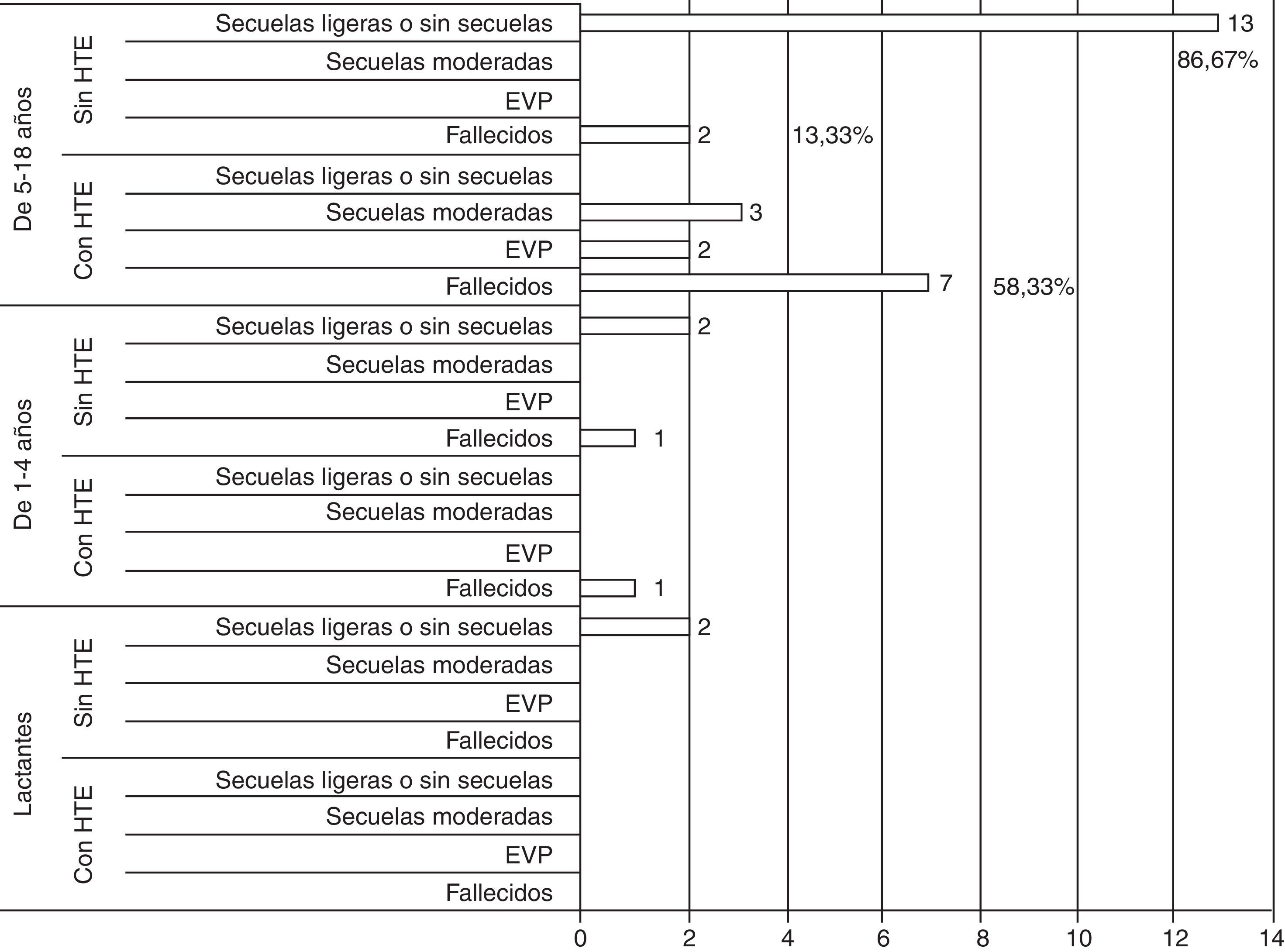
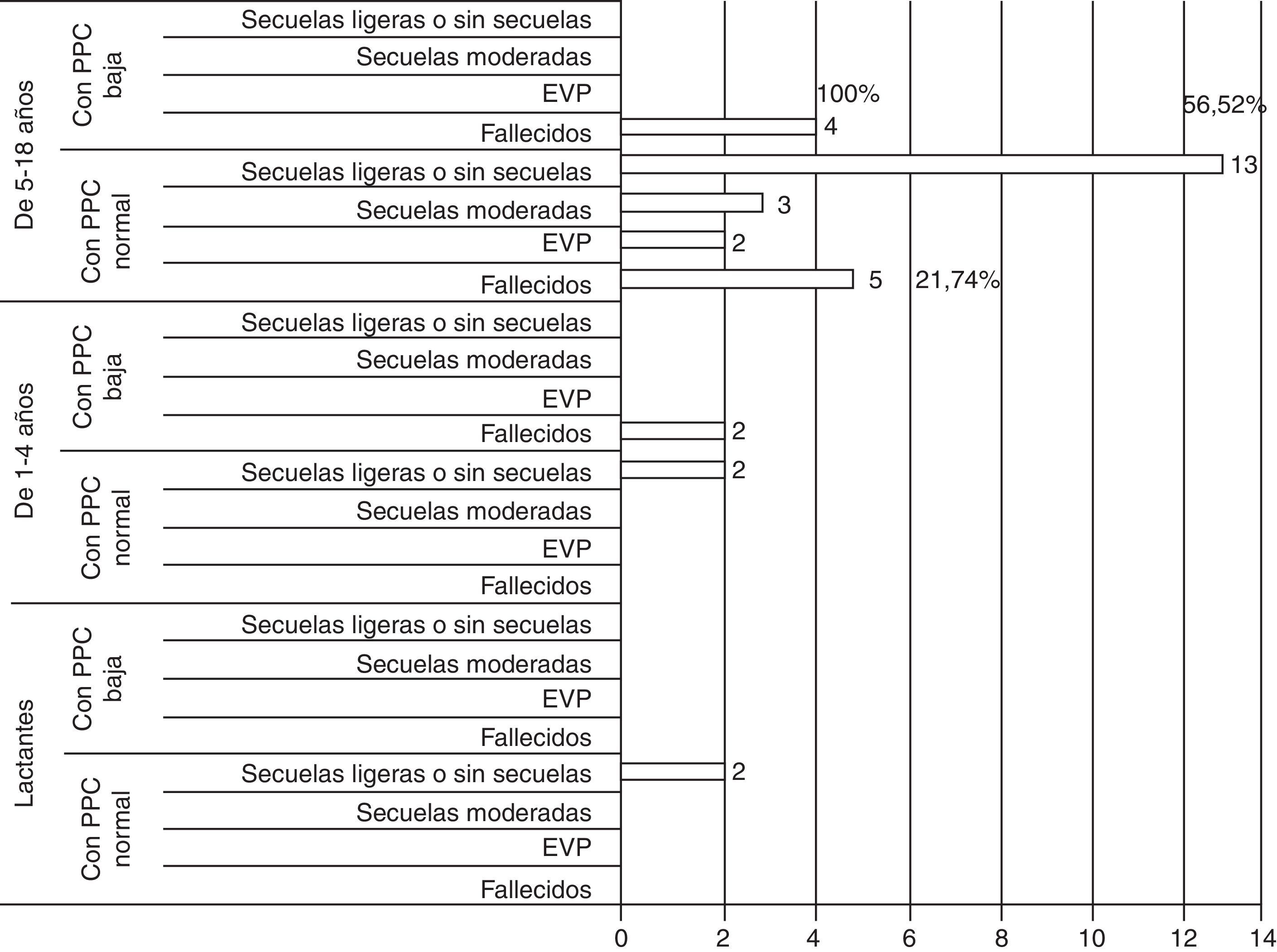
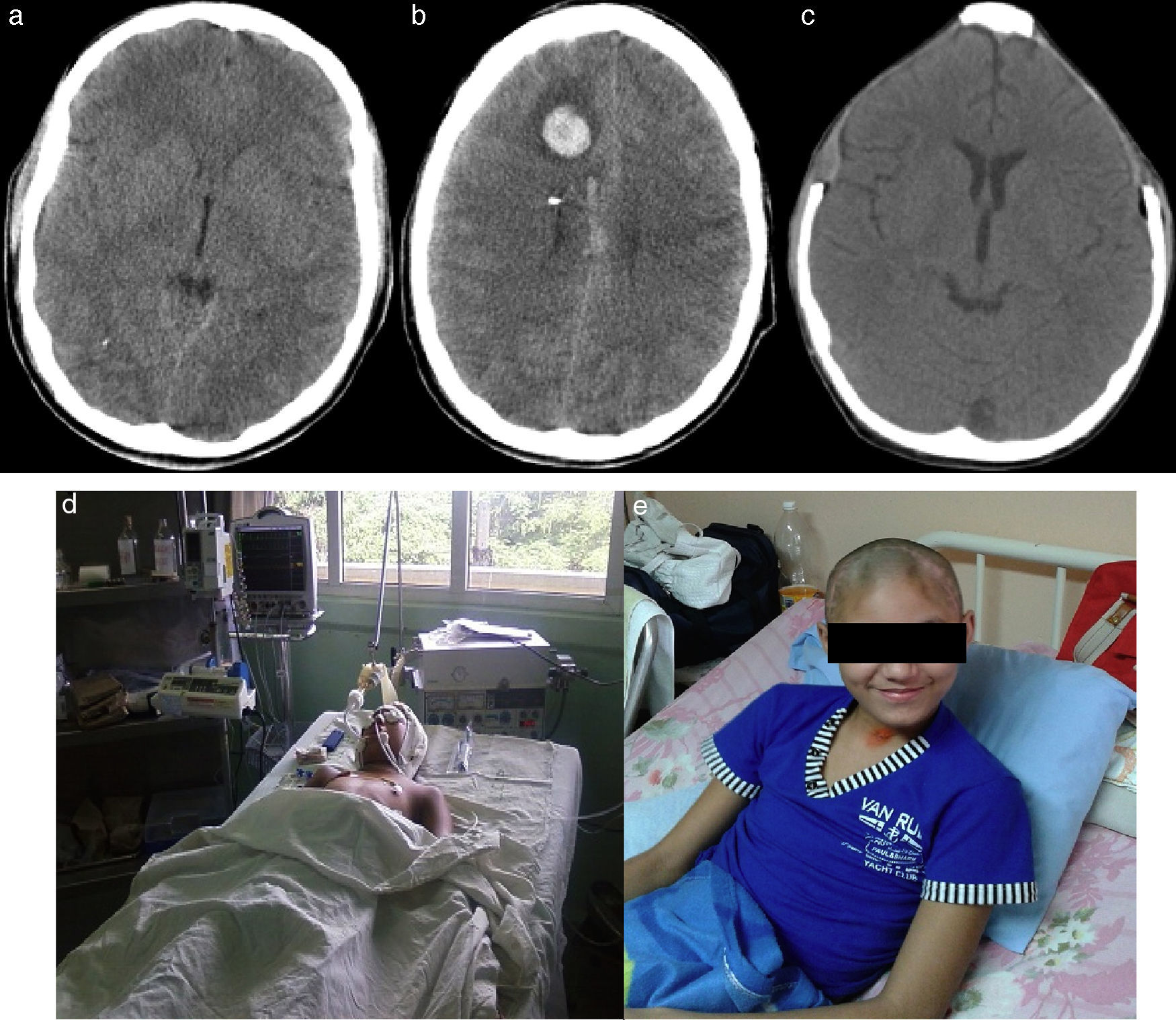
ResultadosSe encontró correlación entre las imágenes de TAC al ingreso y el grado de luxación de las estructuras de línea media con los resultados. Se observó la existencia de una relación directamente proporcional entre la presión intracraneal y los resultados, los valores normales para cada grupo de edad se asociaron a mejores resultados y viceversa. La utilización de la CD precoz facilitó el rápido control de la hipertensión intracraneal en los pacientes con TCE grave y se evidencia la relación entre los valores normales de presión de perfusión cerebral para cada grupo de edad y las secuelas ligeras o ausencia de estas en la ERG.
ConclusionesLa neuromonitorización aporta información indispensable para adoptar una postura terapéutica en el manejo de los pacientes pediátricos con un TCE grave.
Severe craniocerebral trauma is the main cause of morbidity and mortality in children worldwide. Neuromonitoring of these patients in Cuba is not routine in paediatric intensive cares units, and there is no standardised protocol for its use in these units.
Materials and methodsA correlational longitudinal prospective study was conducted on all patients admitted to the paediatric intensive care unit with the diagnosis of severe craniocerebral trauma in the period between January 2003 and December 2014. Continuous neuromonitoring of intracranial pressure and cerebral perfusion pressure was carried out.
ResultsThe results showed that there was a correlation between the initial images of CT scan and the grade of shift of the half line structures. There was a direct relationship between intracranial pressure and the outcomes. The use of early decompressive craniectomy facilitated the rapid control of the intracranial hypertension.
ConclusionsContinuous neuromonitoring contributes to adopt a therapeutic posture in the handling of the paediatric patients with severe head trauma.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".