Las malformaciones arteriovenosas (MAV) del tronco cerebral conllevan un alto riesgo de hemorragia recurrente y de morbimortalidad. Las opciones de tratamiento son limitadas y principalmente asientan sobre la radiocirugía estereotáctica. Estudiamos los resultados de nuestra serie de MAV de tronco tratadas con acelerador lineal (LINAC) con seguimiento a largo plazo.
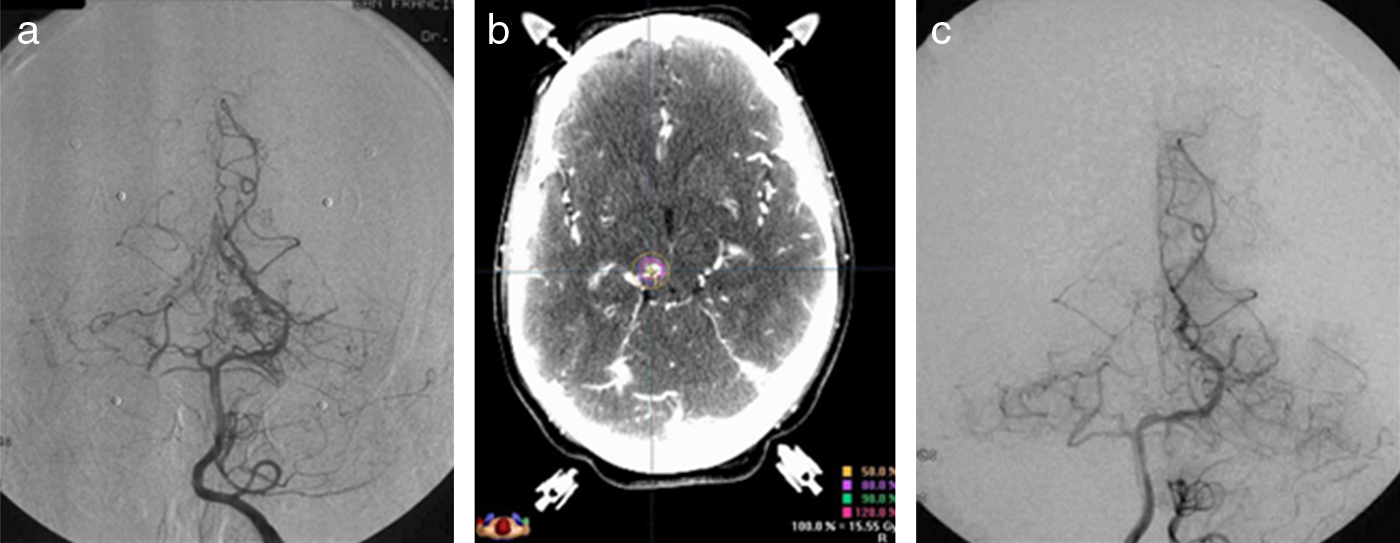
MétodosSe analizan retrospectivamente los datos clínicos y radiológicos de 41 pacientes consecutivos con MAV de tronco tratadas mediante radiocirugía con acelerador lineal de 6MV entre 1992 y 2010. Comprendían 25 lesiones en mesencéfalo, 14 en protuberancia, una en bulbo y otra bulboprotuberancial. Se analizan los resultados del tratamiento en cuanto a supervivencia, tasa de obliteración radiológica, resangrados y toxicidad del tratamiento.
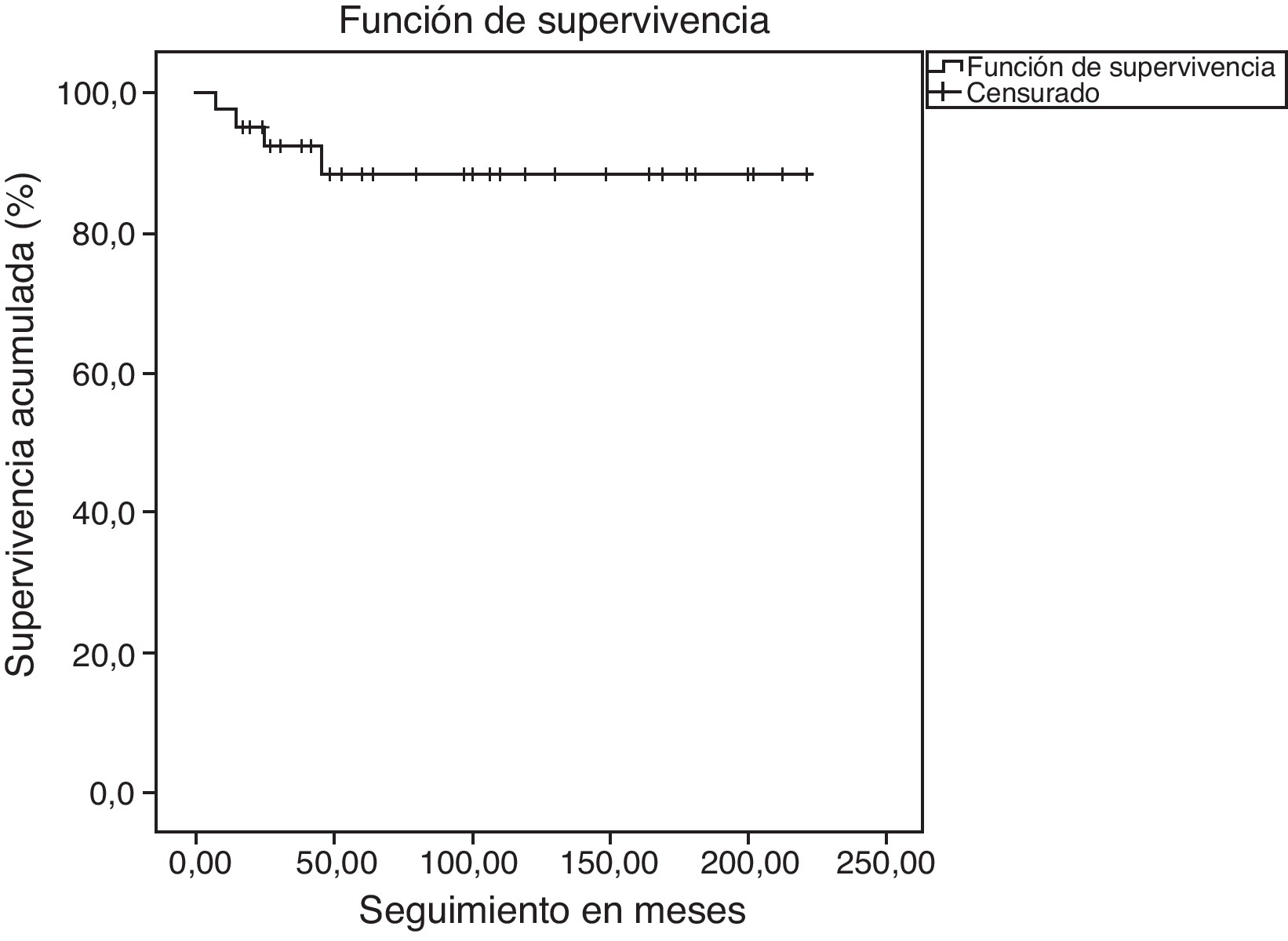
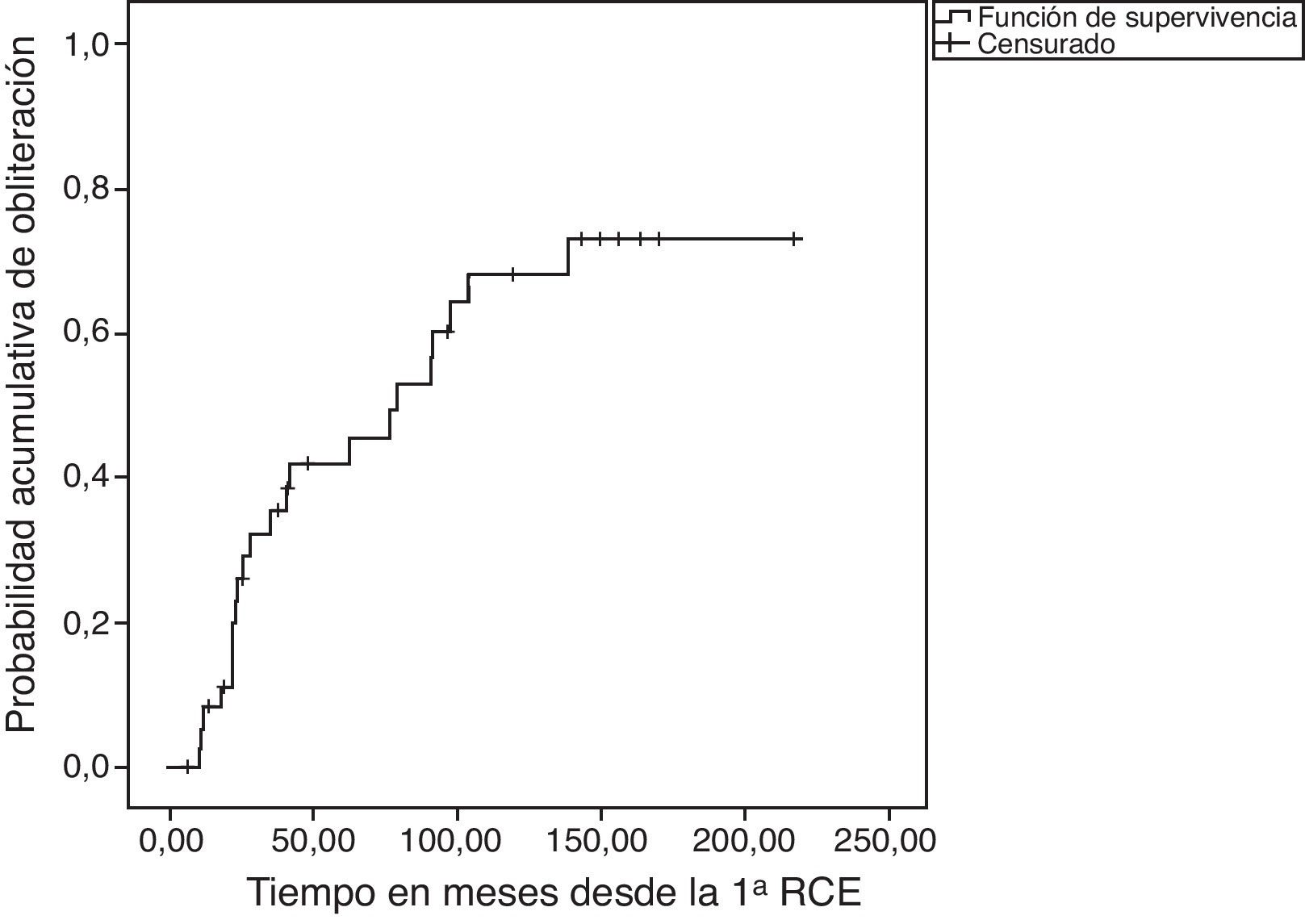
ResultadosSobre 38 pacientes controlados, con una media de seguimiento evolutivo de 61 meses (rango: 6,7-178), la tasa de obliteración confirmada por angiografía/angio-RM fue del 59,5%, con una dosis margen de 14Gy en la gran mayoría de los procedimientos. El 39% de los pacientes recibieron más de un tratamiento de radiocirugía para conseguir el cierre de la malformación. No se observó correlación estadística con la dosis margen, la hemorragia pretratamiento, el diámetro del nido ni la puntuación en el score de Pollock-Flickinger. La tasa de hemorragia anual postratamiento fue de 3,2%; tres pacientes fallecieron por resangrado y la supervivencia actuarial es del 88% a los 5 y 10 años tras el tratamiento. Cuatro pacientes tuvieron nuevos déficits neurológicos transitorios por toxicidad, y solo uno un déficit permanente (2,6%).
ConclusionesLa obliteración del nido en las MAV de tronco debe obtenerse de acuerdo a tres criterios fundamentales: máximo índice de obliteración obligados por su alta proporción de resangrado, mínima morbilidad dada su localización crítica, y con la mayor precisión posible. La radiocirugía estereotáctica con nuestro protocolo de dosis moderadas, al cumplir estas tres premisas, puede convertirse en una modalidad terapéutica electiva para estos pacientes.
Arteriovenous malformations (AVM) in the brainstem carry a high risk of recurrent haemorrhage, mortality and morbidity. Treatment options are limited and mainly based on stereotactic radiosurgery. We studied the results of our series of brainstem AVM treated with linear accelerator (LINAC) and with a long-term follow-up.
MethodsWe retrospectively analysed the clinical and radiological data of 41 consecutive patients with brainstem AVM treated by radiosurgery with a 6MV linear accelerator between 1992 and 2010. Twenty five lesions were located in the mesencephalon, 14 in the pons, one in the medulla oblongata and one was bulbopontine. We analysed the treatment results in relation to survival, rate of radiological obliteration, rebleeding, and treatment toxicity.
ResultsThe obliteration rate confirmed by angiography/MRA was 59.5% on 38 controlled patients. The mean follow-up period was 61 months (range: 6.7-178) and the margin dose was 14Gy in most treatments. Up to 39% of patients received more than one radiosurgery procedure to achieve closure of the malformation. No statistical correlation was found with the margin dose, presence of pretreatment haemorrhage, nidus diameter or score on the Pollock-Flickinger grading system. The annual haemorrhage rate after radiosurgery was 3.2%. Three patients died from rebleeding and actuarial survival rate was 88% at 5 and 10 years after treatment. Four patients suffered new transient neurological deficits due to toxicity, and only one presented a permanent deficit (2.6%).
ConclusionsNidus obliteration in brainstem AVM must be achieved according to three main criteria: maximum obliteration rate forced by the high rate of rebleeding, minimal morbidity given its critical location, and the greatest possible accuracy. Stereotactic radiosurgery with our moderate-dose protocol, which we believe achieved these three premises, may become an elective therapeutic modality for these patients.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".