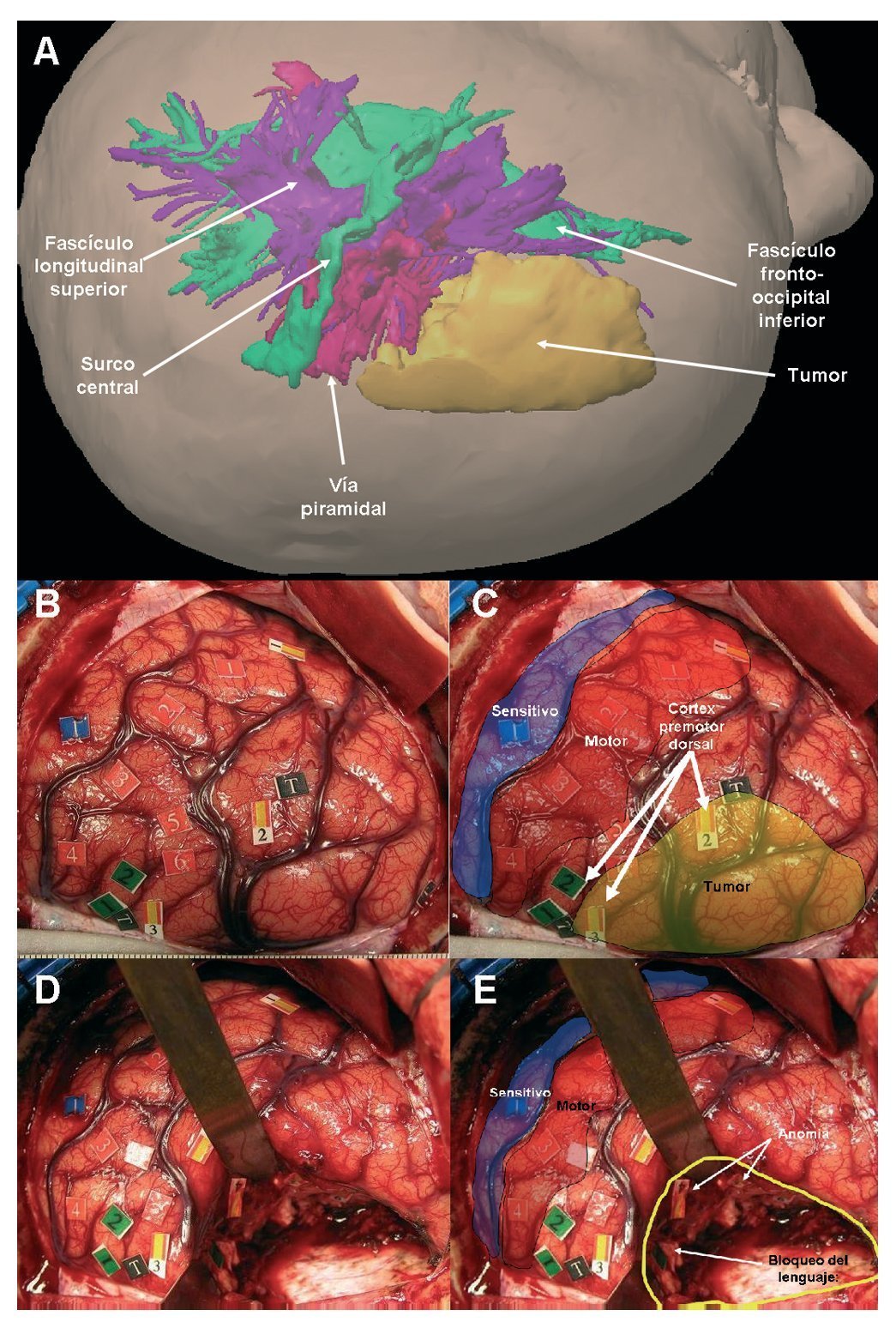
Estudios recientes han demostrado que los gliomas difusos de grado II (GGII), localizados en áreas elocuentes del cerebro, representan más del 80% del total de los GGII. El tratamiento de los GGII en áreas elocuentes es todavía hoy controvertido. El abordaje clásico de un GGII en un área elocuente considera que no es posible plantear una cirugía, porque hay un riesgo alto de secuelas neurológicas en un paciente con una exploración neurológica normal. Sin embargo, en los últimos años ha aumentado de forma significativa la seguridad de las cirugías de estos tumores, gracias al desarrollo de técnicas para mapear con precisión la función cerebral. Mediante las técnicas no invasivas de neuroimagen funcional, se obtiene un mapa de la función cortical de todo el cerebro, lo que es de gran ayuda para anticipar los hallazgos durante la cirugía y para planificar el abordaje. La técnica de mapeo por estimulación eléctrica intraoperatoria consiste en la aplicación, durante la intervención quirúrgica, de un electrodo bipolar sobre el tejido cerebral, lo que permite localizar las funciones con gran precisión. Esta técnica se considera hoy día como el procedimiento de elección para realizar una cirugía de un GGII en un área elocuente con seguridad, ya que ha demostrado ser capaz de aumentar el grado de resección y reducir de forma importante el riesgo de secuelas. En todo paciente con la sospecha de un GGII en un área elocuente, debe valorarse la posibilidad de una extirpación tumoral temprana por parte de un equipo multidisciplinario de profesionales especializados en el manejo de estos tumores.
Recent studies have shown that diffuse grade II gliomas (GGII) located in eloquent brain areas represent over 80% of all GGII. The optimal management of these tumours is still controversial. It has long been considered that surgery is not an option for GGII within eloquent areas, due to the high risk of inducing postoperative sequelae in patients with normal neurological explorations. However, the safety of these surgeries has significantly improved in recent years due to the rapid development of techniques enabling a precise mapping of brain functions. Noninvasive functional neuroimaging techniques have been recently developed, enabling cortical mapping of the entire brain prior to surgical procedures. Such precise data provide a preoperative estimation of the location of eloquent areas in relation to the tumour, which is essential for surgical planning and preoperative assessment of morbidity for various surgical approaches. The intraoperative electrical stimulation (IES) mapping technique consists in the application of a bipolar electrode on the brain tissue, enabling an accurate location of brain functions. This provides unique assistance in GGII resection, as it generates a discrete and transient "virtual" lesion within the eloquent tissue. Tumour removal is then tailored according to functional boundaries in order to optimise the quality of resection and to minimise the risk of postoperative sequelae, preserving quality of life. For patients with a GGII in an eloquent area, the possibility of an early resection should be evaluated by a multidisciplinary neuro-oncology team specialising in the management of such tumours.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".