Introducción y objetivo: En los últimos años, los abordajes endonasales expandidos (AEE) se están convirtiendo en una técnica de primer nivel para el tratamiento de diferentes patologías de la base del cráneo. En algunos casos, la endoscopia permite la disección de áreas difícilmente accesibles con los abordajes tradicionales. A propósito de un caso de displasia fibrosa (DF) basicraneal, nuestros objetivos son mostrar como los AEE pueden ser una técnica quirúrgica segura y eficaz para la descompresión de estructuras neurovasculares de la base de cráneo y realizar una revisión bibliográfica de la literatura inglesa disponible respecto a la DF, así como de los AEE transpterigoideos, estableciendo una descripción exacta de la técnica y plasmando nuestra experiencia operatoria en este campo.
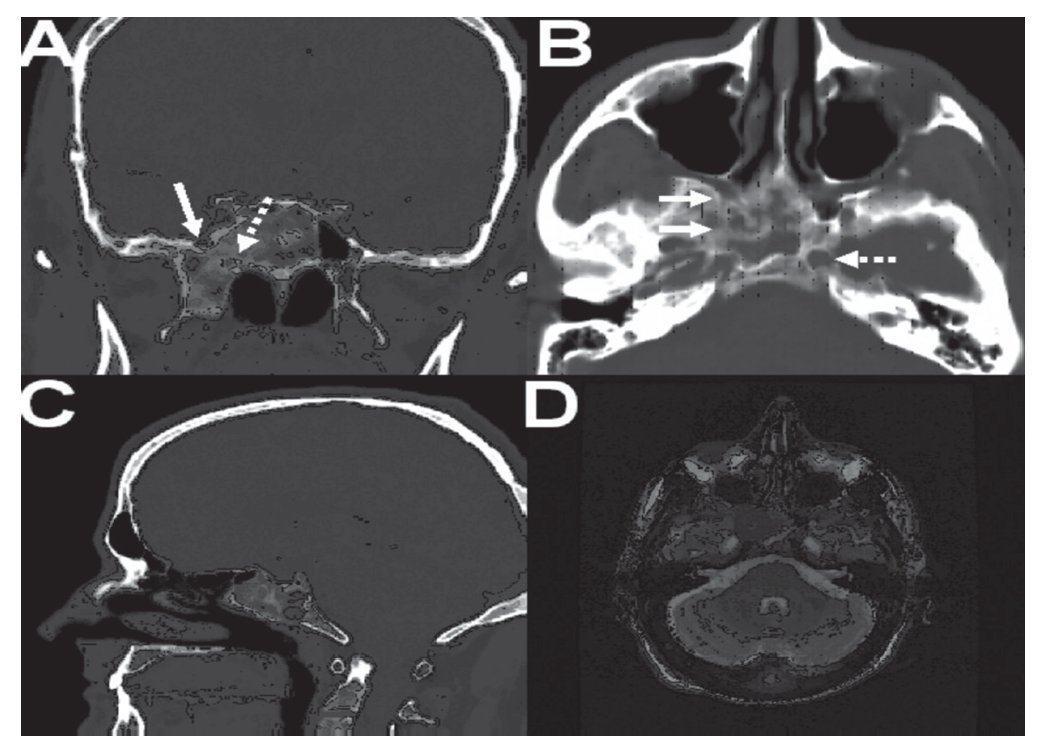
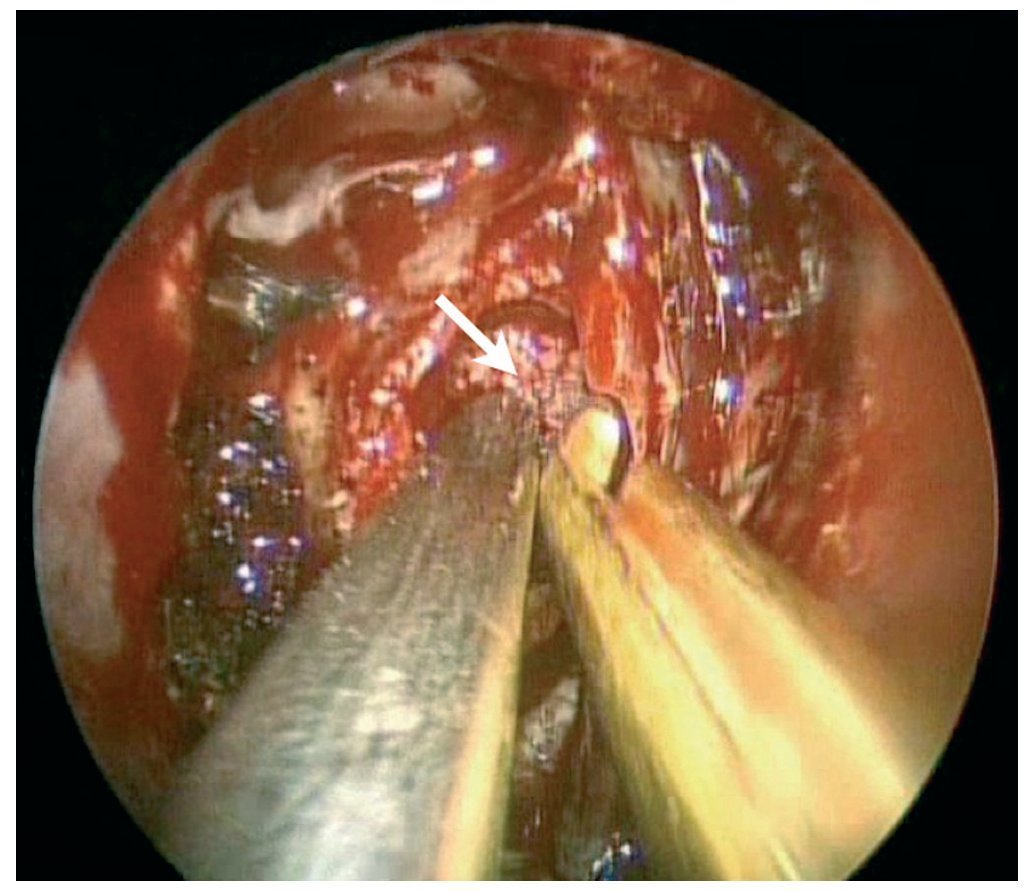
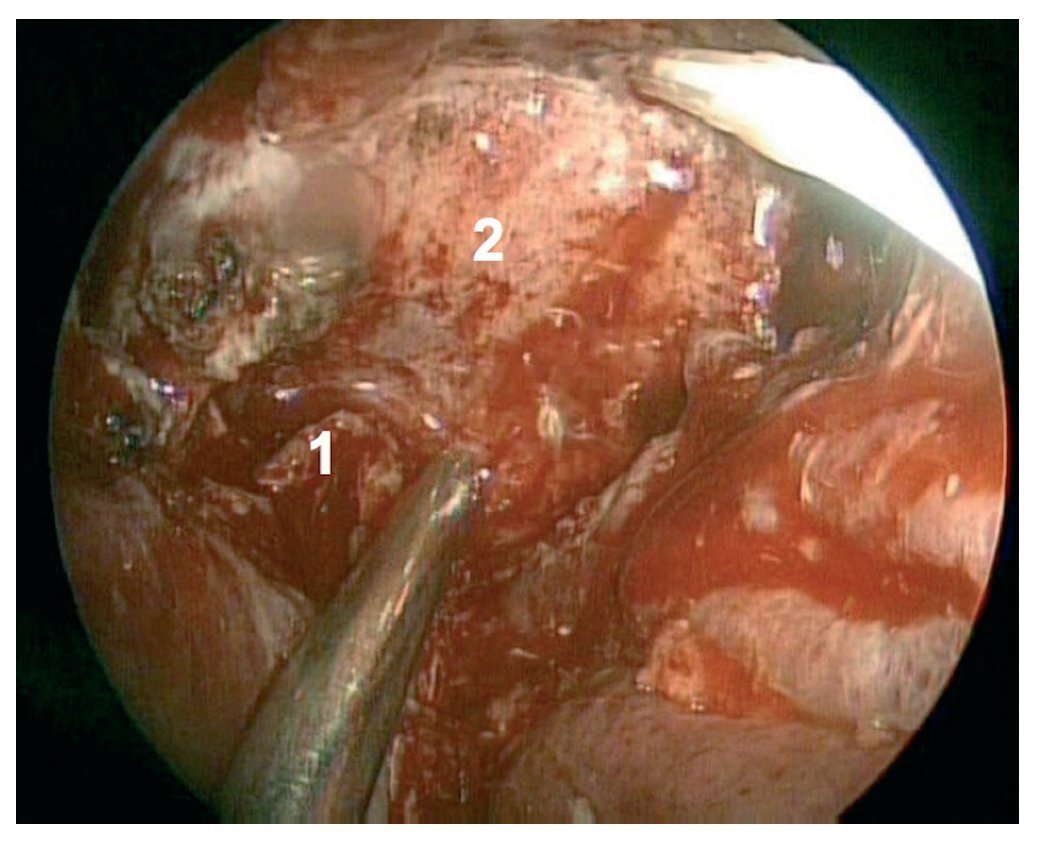
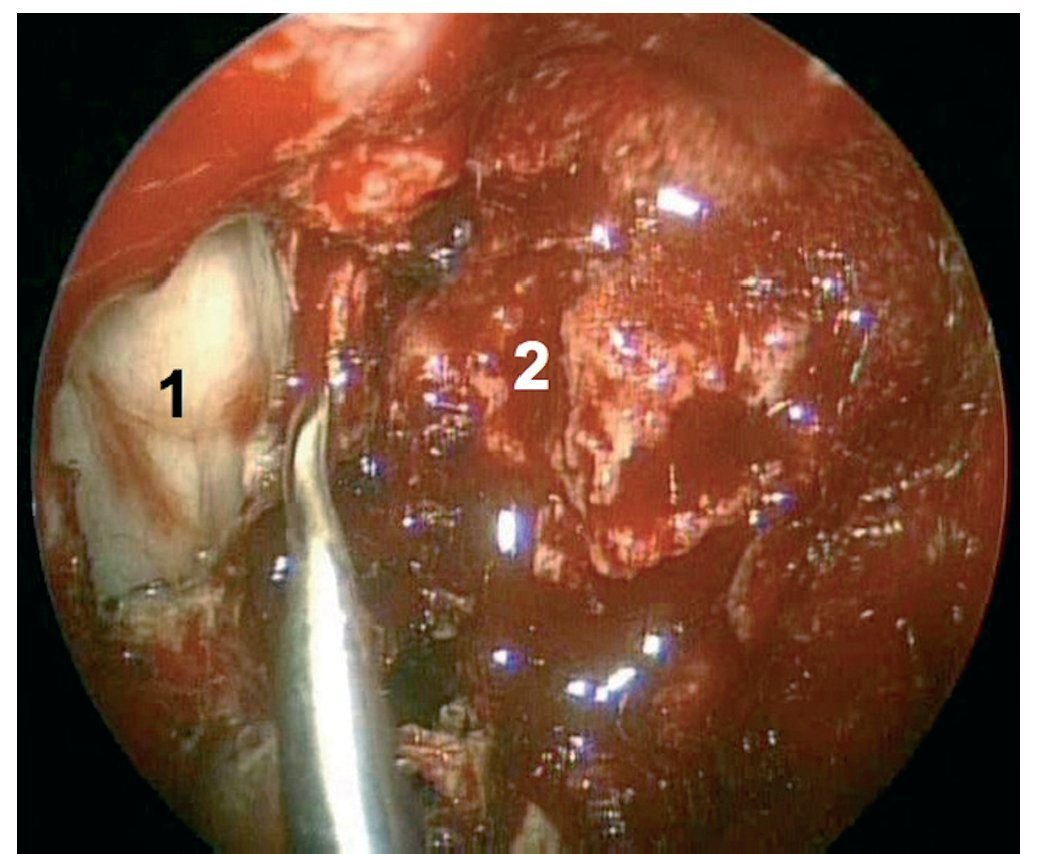
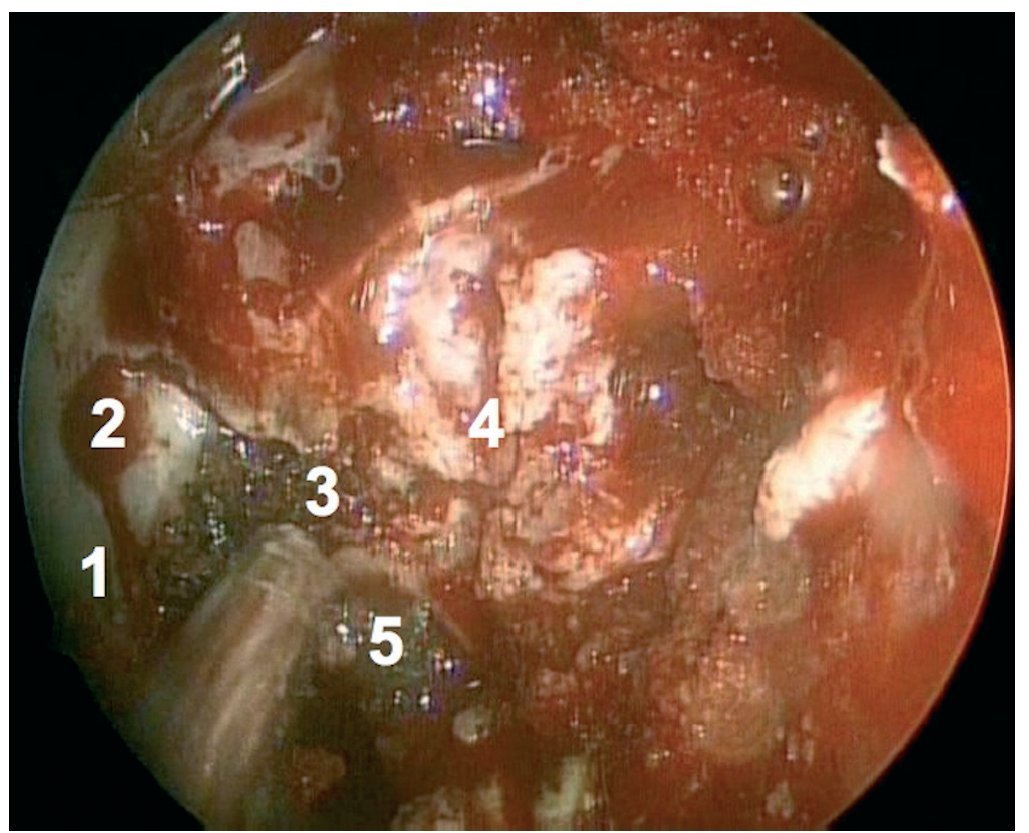
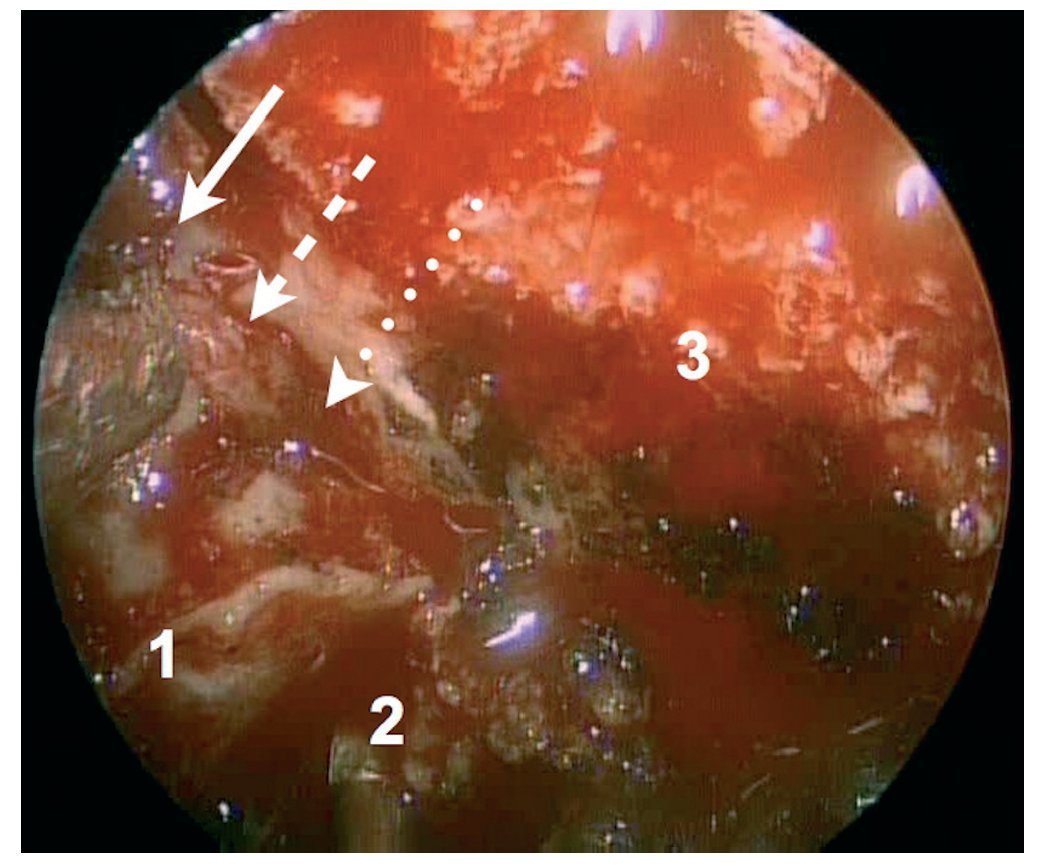
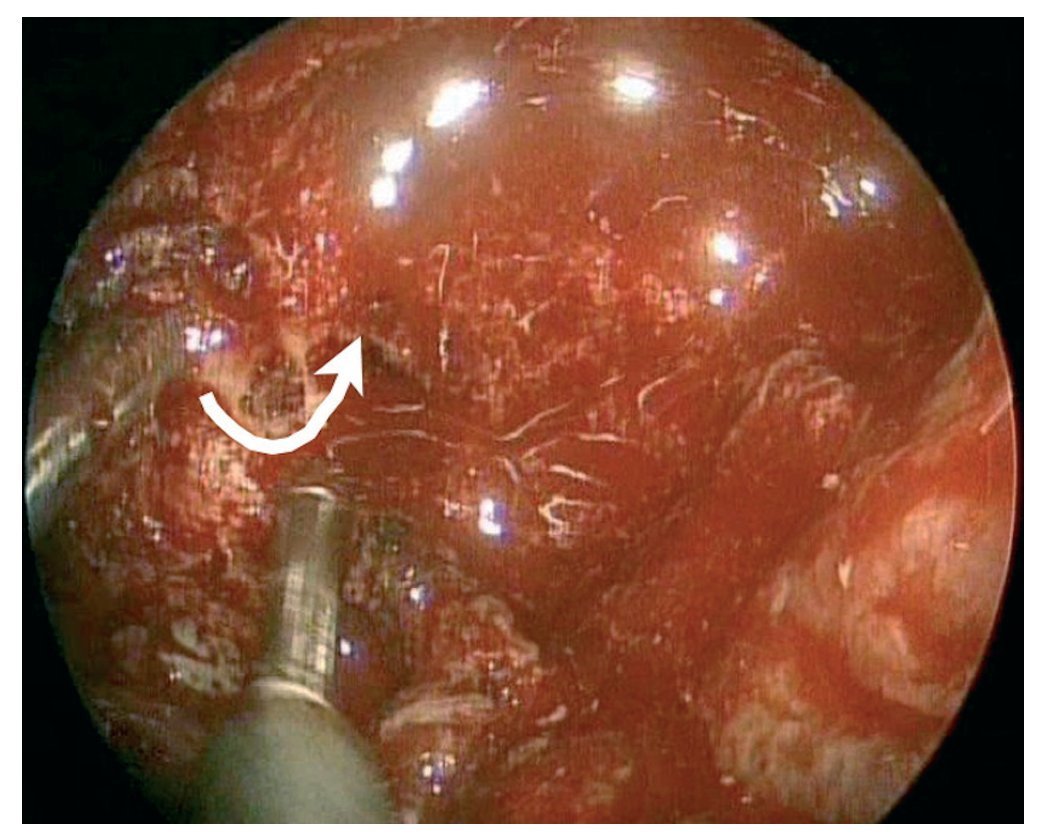
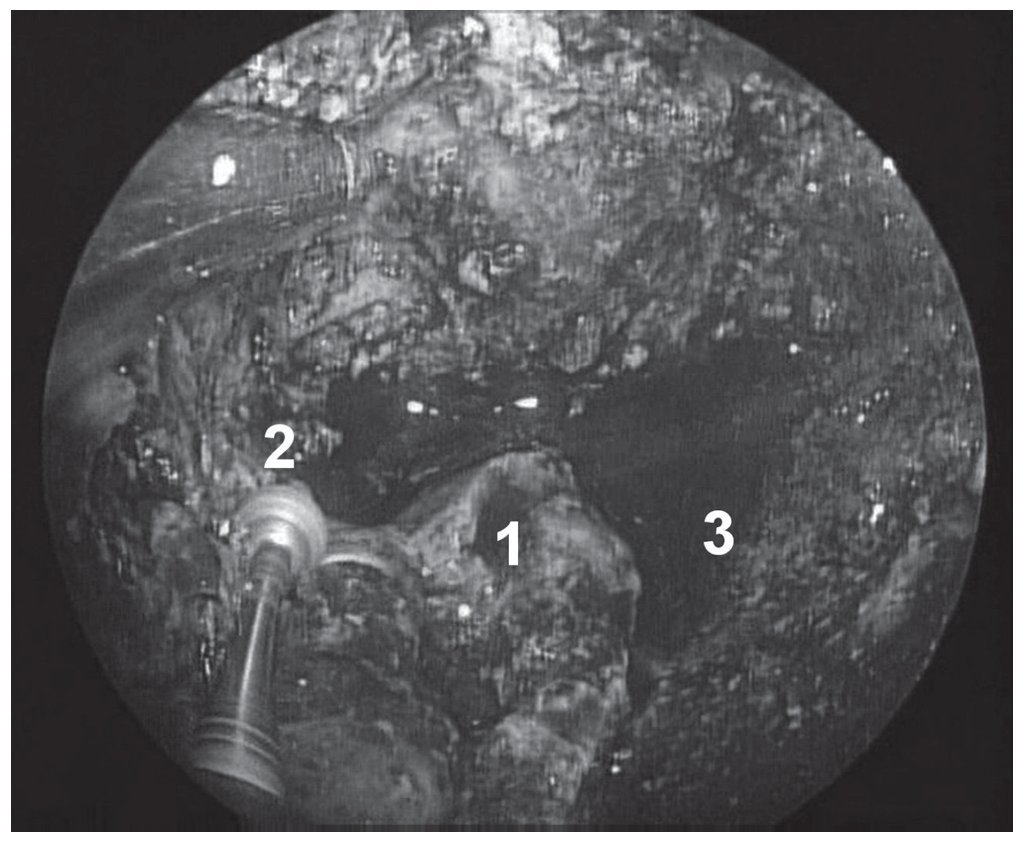
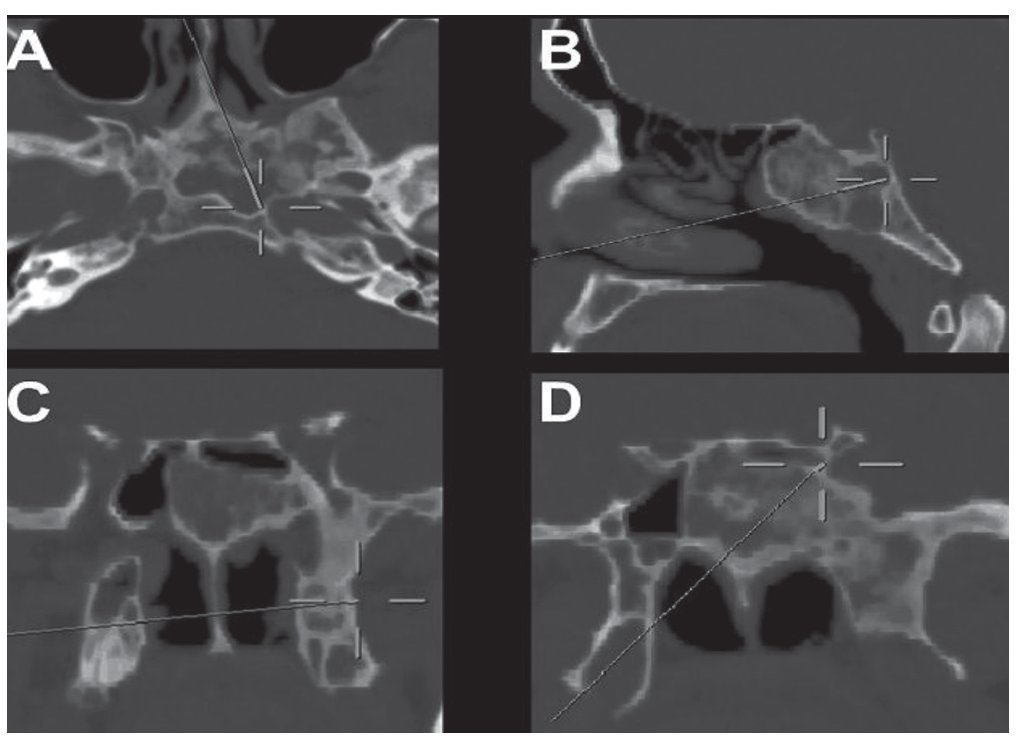
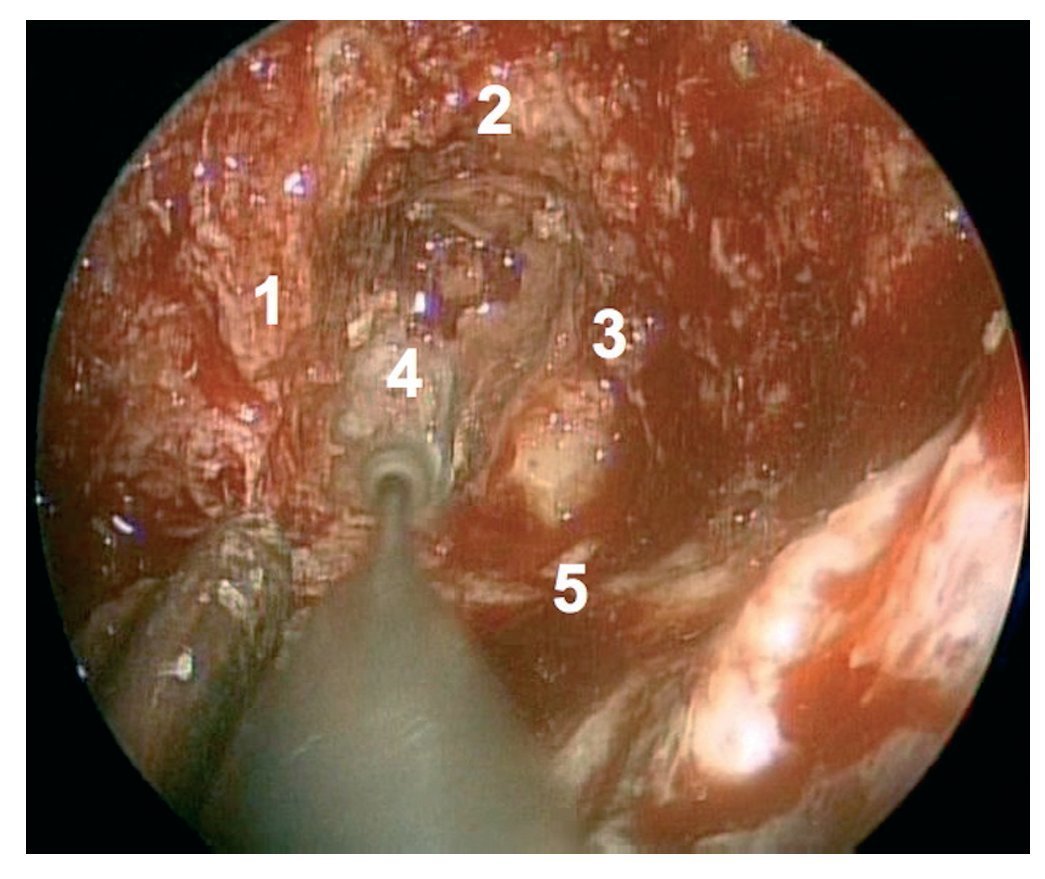
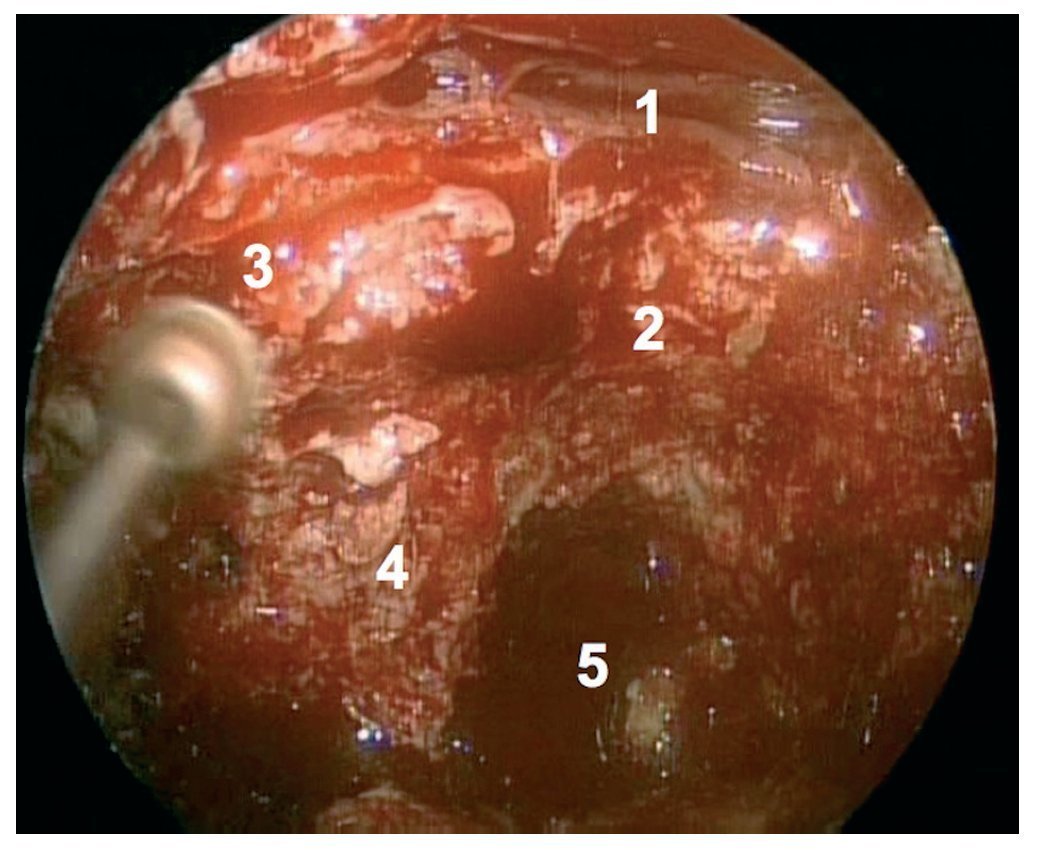
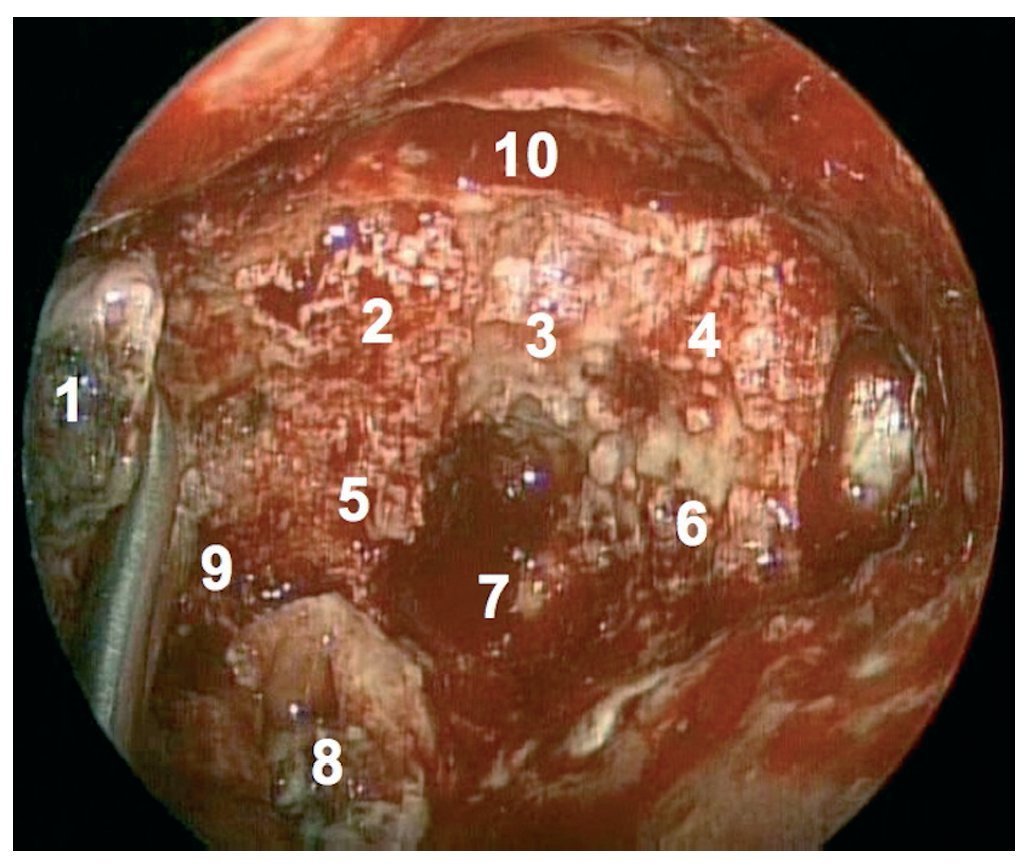
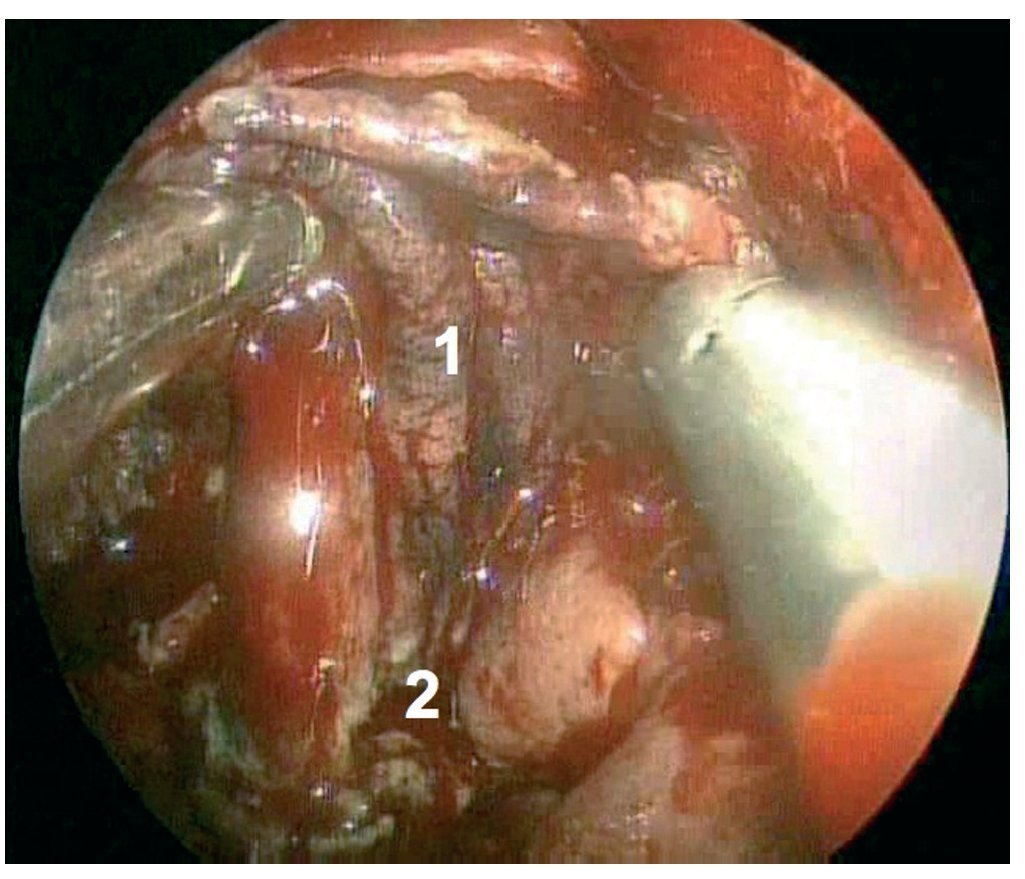
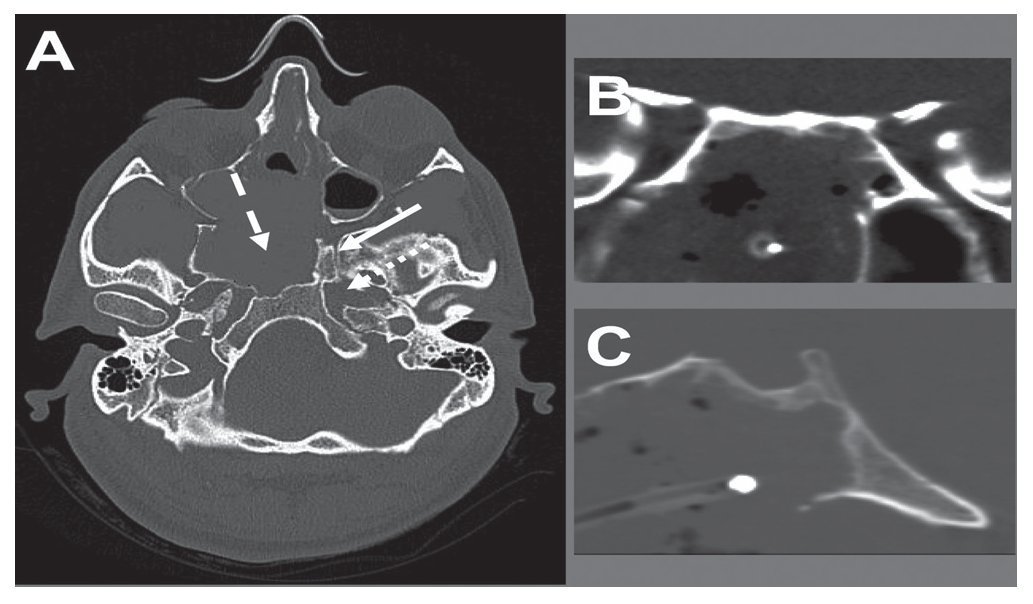
Caso clínico: Varón de 42 años de edad con paresia del VI par craneal derecho y estudios de imagen mediante resonancia magnética y tomografía computarizada craneales sugestivos de displasia fibrosa esfenoclival. Se lleva a cabo un abordaje endonasal expandido transpterigoideo completamente endoscópico, obteniéndose una amplia descompresión de las estructuras vasculonerviosas de la base del cráneo. Durante el procedimiento se utiliza neuronavegación y el canal vidiano como referencia anatómica fundamental de la carótida en su segmento lacerum.
Discusión: El AEE transterigoideo es una técnica segura y con amplio sustento en la literatura científica. En manos adecuadas, podría reducir la morbilidad asociada a los abordajes transcraneales clásicos, ya que permite un máximo potencial resectivo sobre las lesiones a tratar, con una mínima distorsión sobre las estructuras craneofaciales circundantes. Para su realización se utilizan referencias anatómicas claves como el agujero y canal del nervio vidiano. La indicación de tratamiento quirúrgico en los casos de DF de base craneal ha de establecerse en función de la presencia de sintomatología.
Conclusiones: El abordaje endonasal expandido transperigoideo para el tratamiento de la DF basicraneal es un método seguro y eficaz gracias a la guía que el canal del nervio vidiano proporciona para localizar el segmento lacerum de la arteria carótida.
Introduction: Expanded endonasal approaches (EEA) are becoming a first-level technique for the treatment of skull base pathologies. In some cases, the endoscopic procedures make it possible to dissect structures manipulated with greater difficulty in the classic approaches. We report a full endoscopic transpterygoid EEA for the treatment of a fibrous dysplasia (FD) of the skull base. In addition, we reviewed the English literature available on FD and transpterygoid EEA, establishing an exact surgical technique and showing our intraoperative experience.
Case report: A 42-year-old male with right sixth cranial nerve palsy. Cranial MRI and CT showed a central skull base lesion with diagnostic suspicion of FD. Patient underwent a full endoscopic transpterygoid EEA, achieving a wide skull base neurovascular decompression. Neuronavigation and the vidian canal landmark resulted mandatory during intraoperative procedure.
Discussion: The transpterygoid EEA is a safe technique consistently supported in the literature. It may reduce the morbidity associated to the classic transcranial approaches, since it permits maximum resection with minimum craniofacial distortion. The vidian hole and canal are the landmarks used to locate and avoid injury to the lacerum segment of the carotid injury. The surgical treatment indication in FD cases must be established in symptomatic patients.
Conclusion: Transpterygoid EEA for treatment of FD of the skull base is a safe and effective procedure, thanks to the guide that the vidian canal provides in finding the lacerum segment of the carotid artery.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".