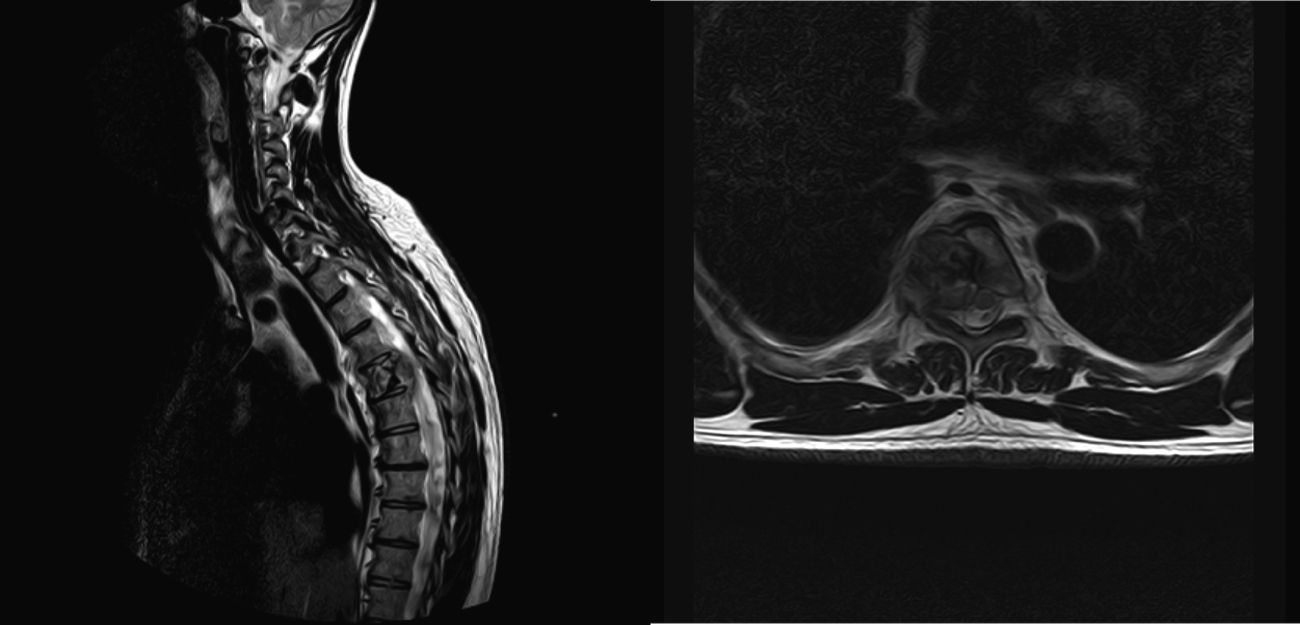
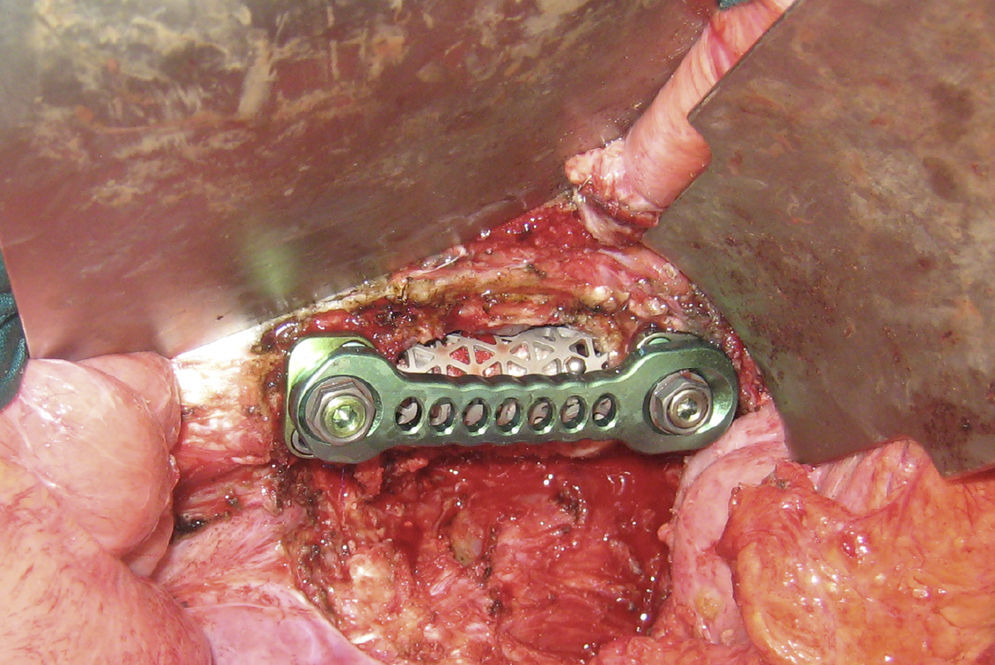
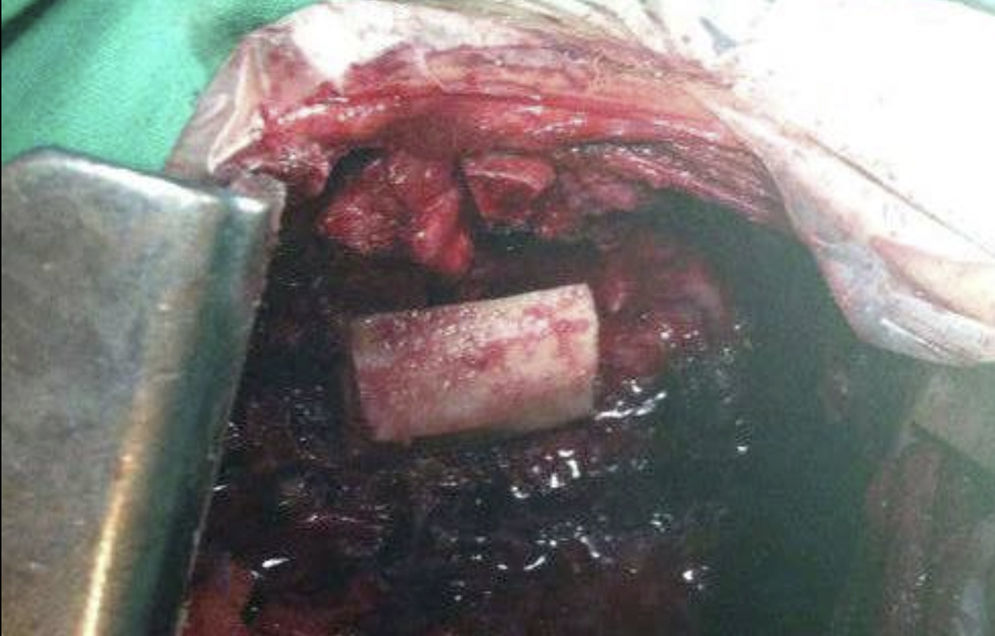
Analizar los resultados de los pacientes con metástasis en columna torácica y lumbar intervenidos mediante abordaje anterior o anterolateral.
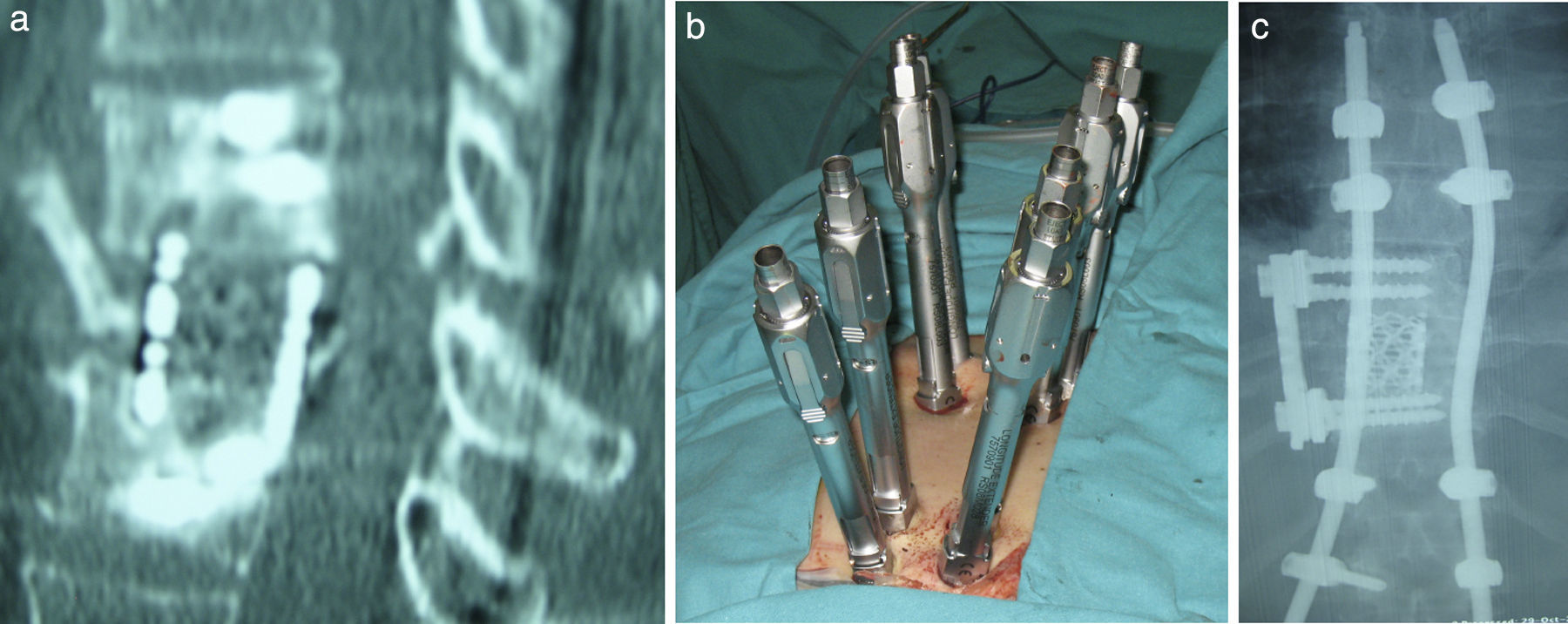
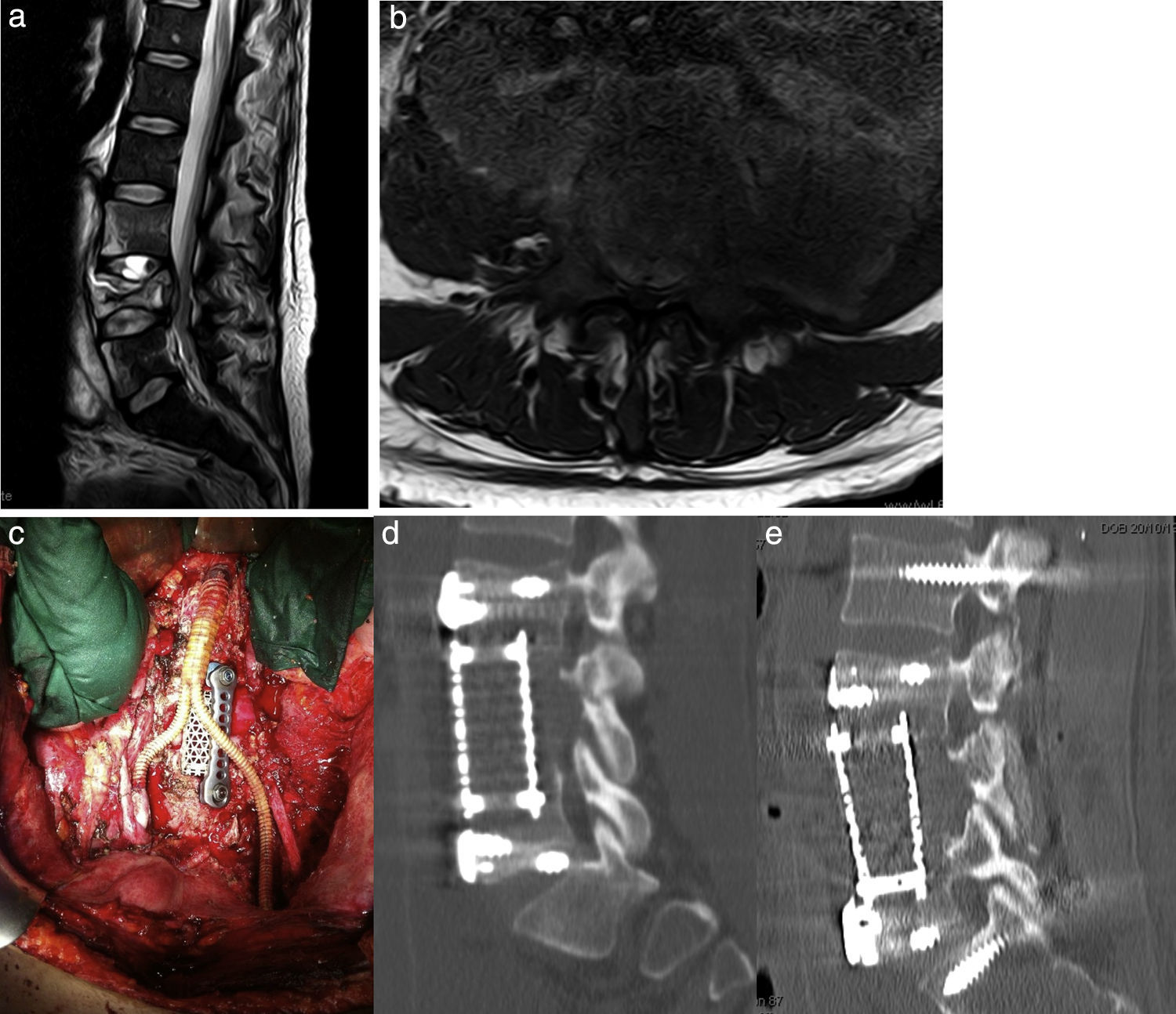
Materiales y métodosSe han analizado de forma retrospectiva los pacientes con lesiones vertebrales metastásicas a nivel dorsolumbar intervenidos por vía anterior o anterolateral en nuestra institución entre los años 2003 y 2012.
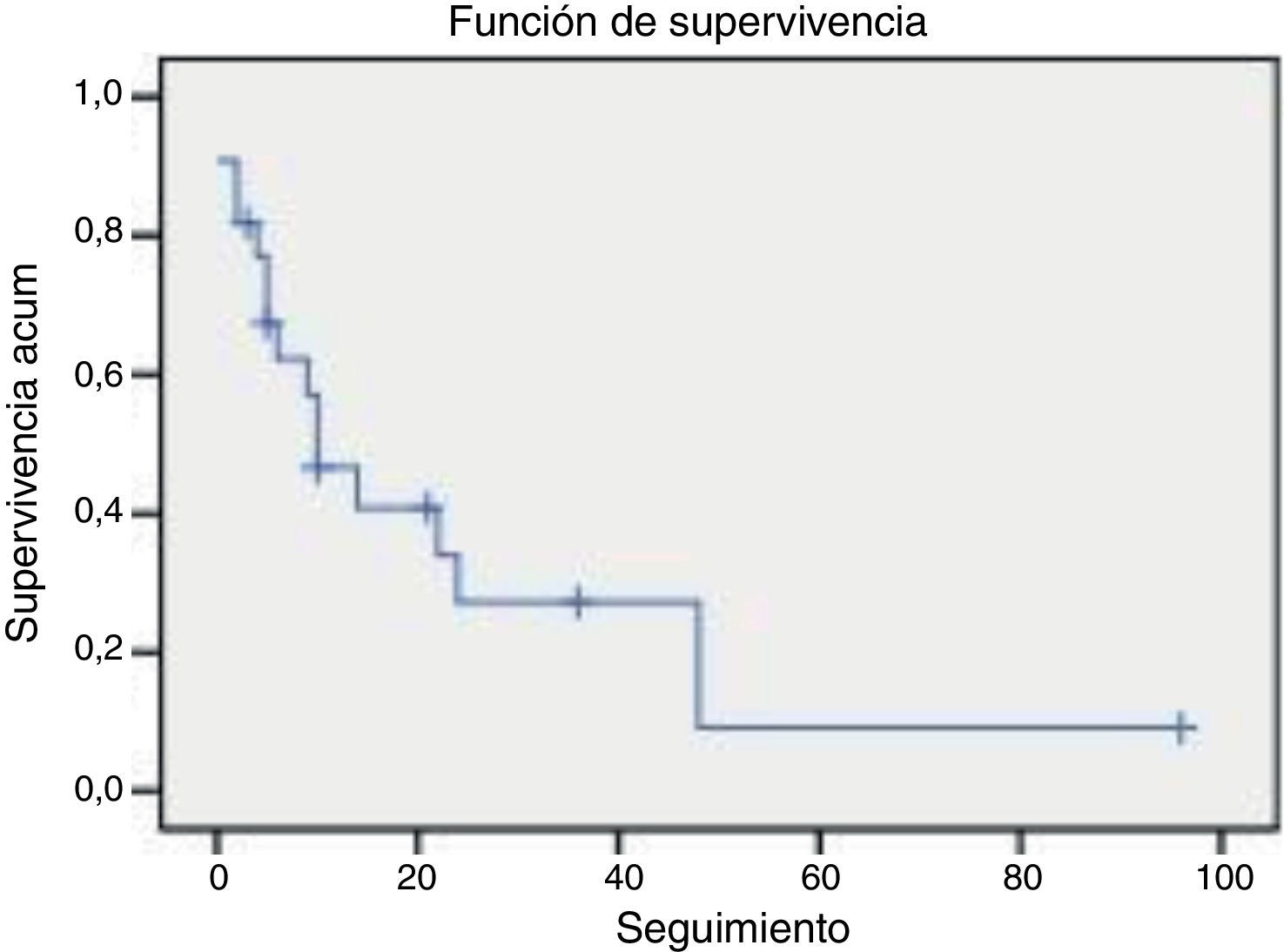
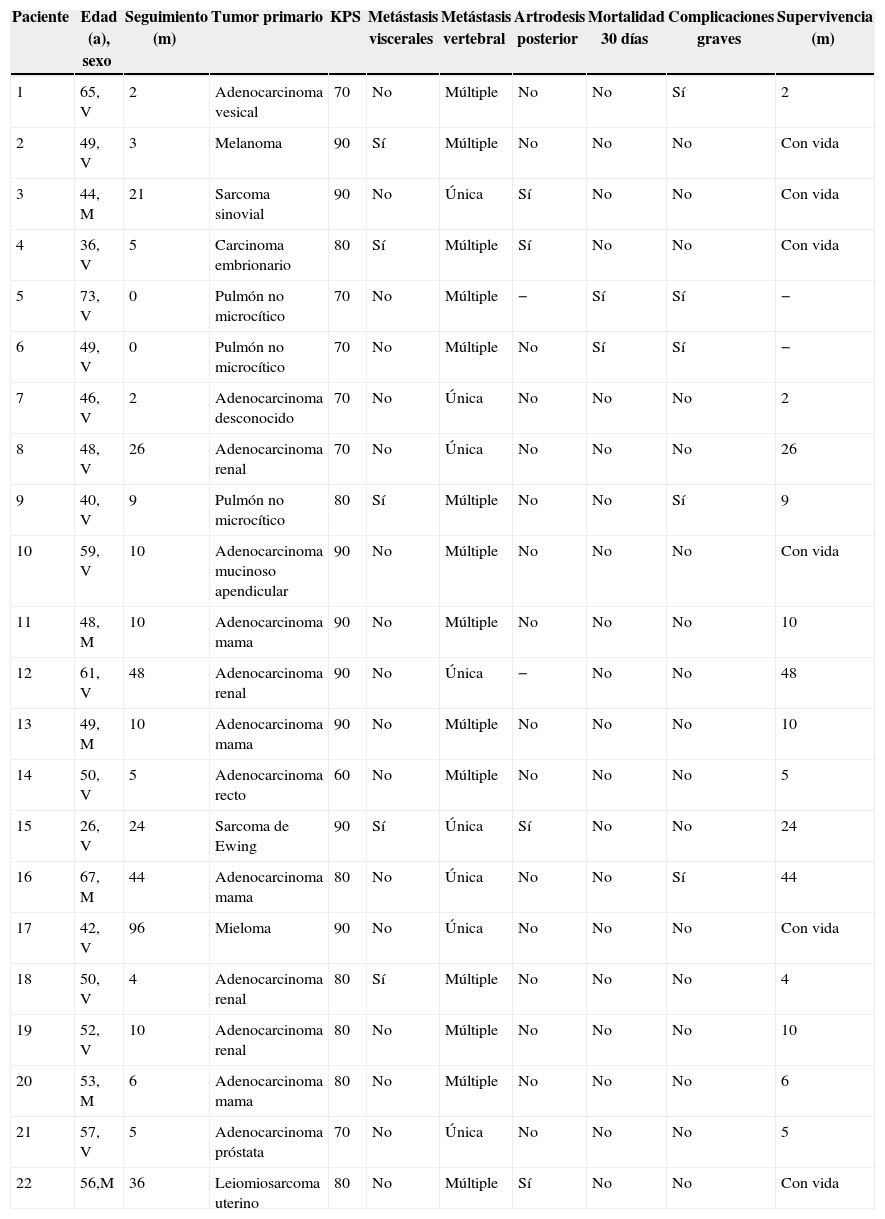
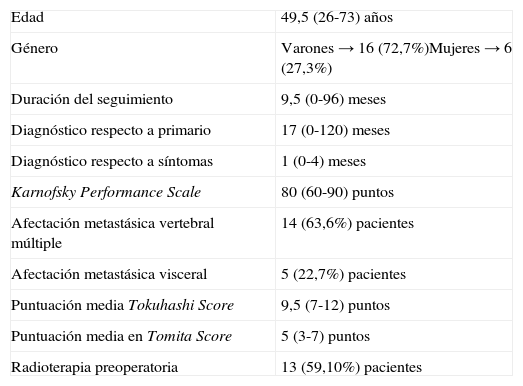
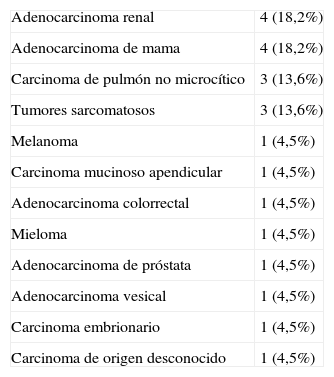
ResultadosSe incluyeron un total de 22 pacientes, con una mediana de edad de 49,5 años (26-73 años) y una mediana de seguimiento de 9,5 meses (0-96 meses). Las neoplasias primarias más frecuentes fueron el adenocarcinoma renal y el adenocarcinoma de mama. Se realizó arteriografía prequirúrgica en 14 (63,6%) de los pacientes, llevándose a cabo la embolización de la lesión en 7 (31,8%) de ellos. Previo a la intervención, 12 (54,5%) de los pacientes eran capaces de deambular (Frankel D y E). En 5 (22,7%) de los pacientes aparecieron complicaciones médicas durante el postoperatorio inmediato, 2 (9,1%) de los cuales fallecieron. Entre los 20 restantes, el número de pacientes deambulantes (Frankel D y E) al final del seguimiento fue de 16 (72%). En el 90% se redujo la demanda de analgesia al menos un 50%. Durante el seguimiento, 16 (72,2%) de los pacientes fallecieron con una mediana de supervivencia de 10 meses (rango 0-48 meses).
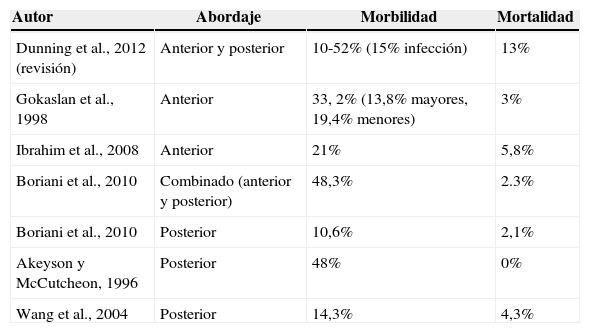
ConclusionesLa resección de las metástasis vertebrales dorsolumbares por vía anterior o anterolateral, pese a acompañarse de una morbimortalidad considerable, resulta efectiva de cara a preservar o recuperar la deambulación, así como para lograr el control del dolor. La arteriografía preoperatoria con la eventual embolización de la lesión constituye una herramienta importante.
To analyse the results of the anterior and anterolateral approaches in the treatment of thoracic and lumbar spine metastasis.
Materials and methodsPatients who underwent surgery between 2003 and 2012 in our institution using an anterior or an anterolateral approach for the treatment of thoracic or lumbar spine metastasis were retrospectively reviewed.
ResultsTwenty-two patients with median age of 49.5 years (26-73 years) and median follow-up of 9.5 months (0-96 months) were analysed. The most common primary malignancies were renal cell carcinomas and breast adenocarcinomas. Before the intervention, 12 (54.5%) patients were able to walk (Frankel D and E). Preoperative arteriography was performed in 14 (63.6%) patients, and 7 (31.8%) of them underwent tumour embolisation. Medical complications occurred in 5 (22.7%) patients during the immediate postoperative period, 2 (9.1%) of whom died. At the end of follow-up, 16 (72%) of the remaining 20 patients were able to walk (Frankel D and E). Ninety percent of the patients could reduce at least 50% of their analgesic drug requirements. During follow-up 16 patients died, with a median survival of 10 months (range 0-48 months).
ConclusionsResection of thoracolumbar vertebral metastases by an anterior/anterolateral approach, despite its considerable risk of morbidity and mortality, offers the possibility of significant improvement in the quality of life of the patient; and it does so not only by preserving or restoring their ability to walk but also by ameliorating pain. Preoperative angiography, considering the embolisation of the lesion, is an important tool.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".