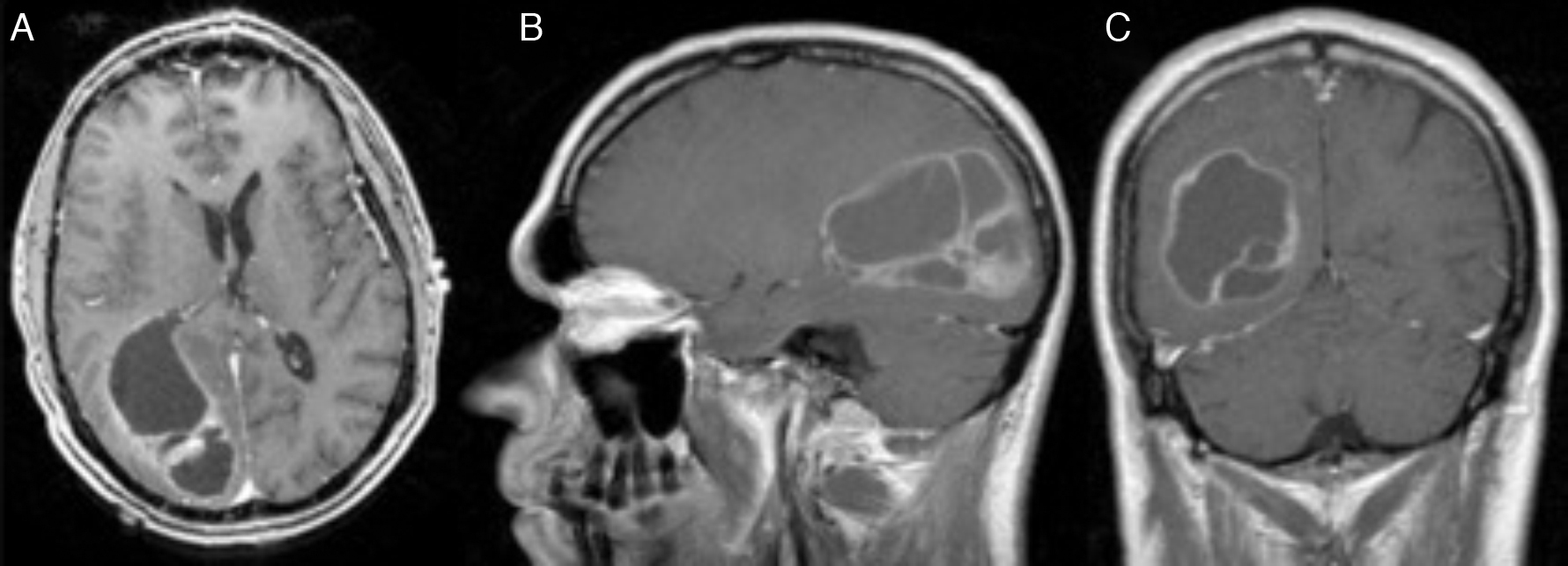
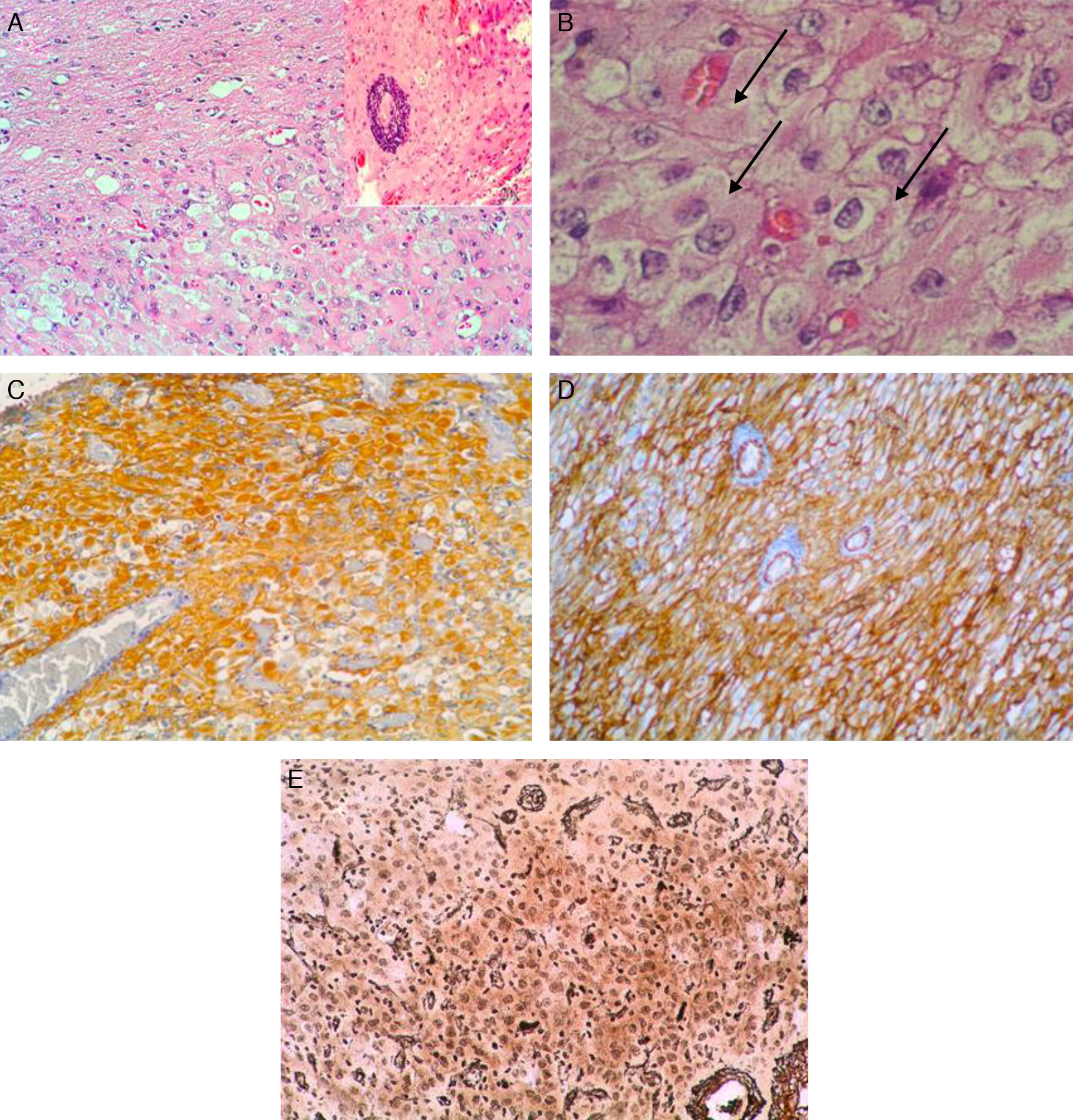
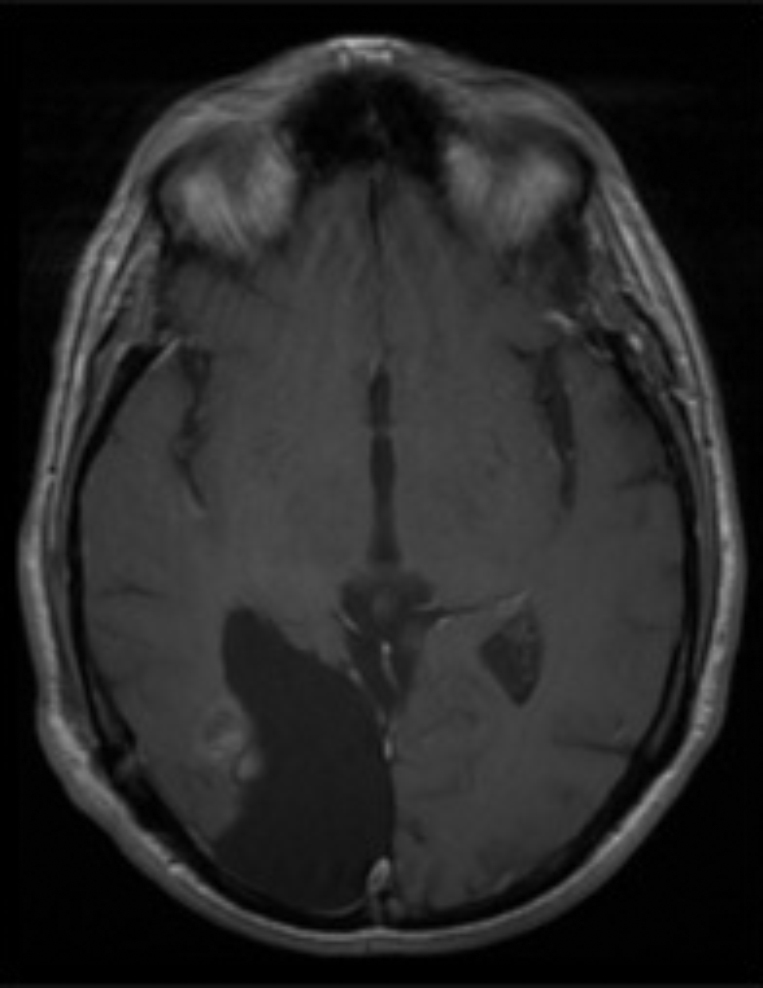
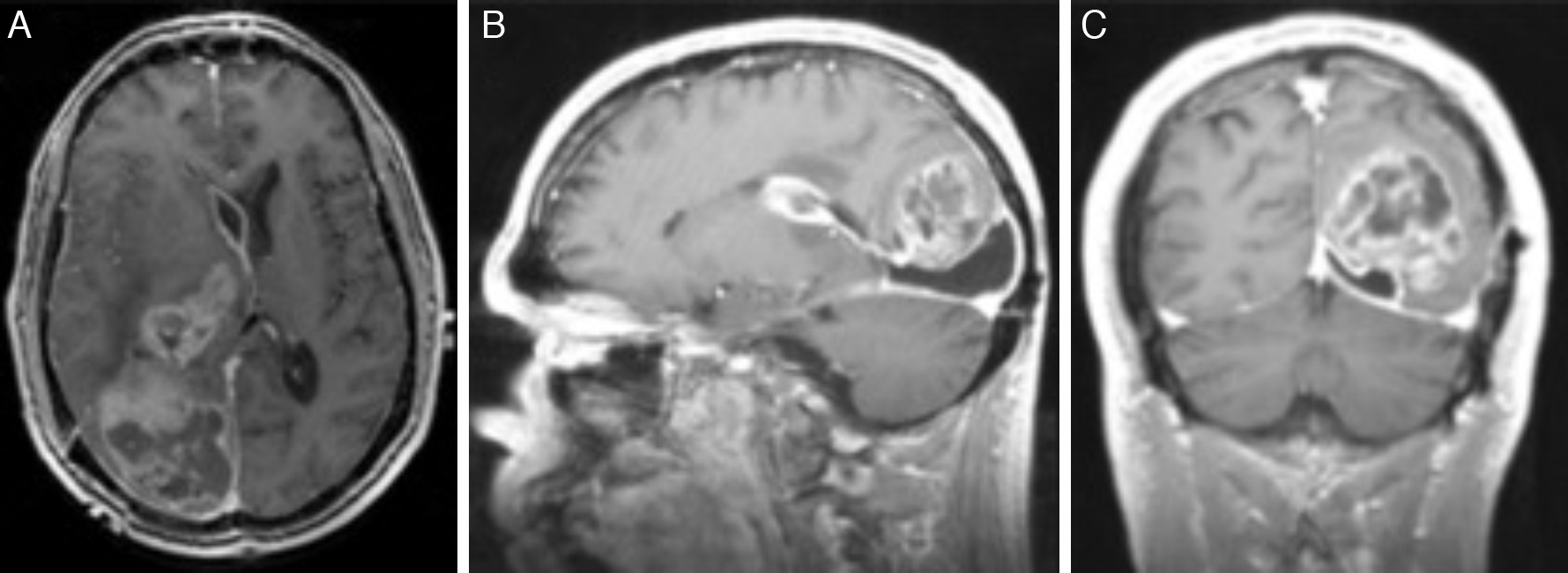
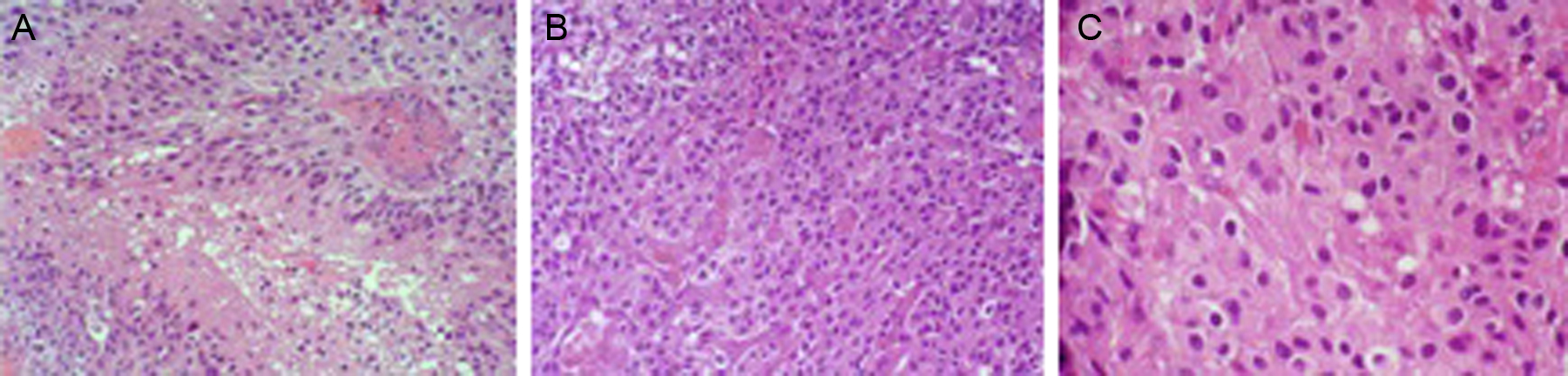
El xantoastrocitoma pleomórfico (XAP) es un tumor astrocitario raro, de localización más frecuente superficial en hemisferios cerebrales de niños y adultos jóvenes. Se trata de un tumor de bajo grado que tiene un pronóstico relativamente favorable; sin embargo, se han descrito pacientes con progresión maligna. Presentamos así un caso inusual de un varón de 54 años con una tumoración multiquística parietooccipital derecha con extensión intraventricular. Tras la exéresis quirúrgica el estudio histológico mostró una lesión con células pleomórficas, cúmulos de lípidos en su citoplasma, cuerpos granulares intensamente eosinófilos, núcleos únicos bien delimitados y positividad inmunohistoquímica frente a sinaptofisina, proteína gliofibrilar ácida (GFAP), proteína S-100, vimentina y CD56 de forma focal. Tras descartar otras entidades, como metástasis por carcinoma de células grandes y una lesión primaria tipo astrocitoma subependimario de células grandes, se diagosticó de XAP. A los 9 meses de seguimiento el paciente presentó una extensa recidiva tumoral local considerada irresecable, con deterioro neurológico progresivo y signos radiológicos de progresión maligna, confirmados histológicamente mediante la realización de una biopsia cerebral que demostró cambios respecto a la lesión inicial que incluían focos de necrosis, mayor actividad mitótica (5×10 campos de gran aumento) e índice de proliferación celular medido con la tinción nuclear de Ki67 del 10%. El presente caso ilustra la extensión intraventricular, así como un comportamiento agresivo no característico de estas lesiones (similar a un astrocitoma anaplásico o glioblastoma primario), exigiendo un tratamiento quirúrgico óptimo inicial con seguimiento estrecho clínico-radiológico, considerando el potencial de transformación maligna del XAP.
Pleomorphic xanthoastrocytoma (PXA) is a rare, low-grade astrocytic tumour that usually occurs in the superficial cerebral hemispheres of children and young adults. Although it has a relatively favourable prognosis, malignant progression of these tumours has been described. Therefore, we present an unusual case of a 54-year-old male with a right, multicystic, parietooccipital tumour extending through the ipsilateral ventricle. After surgical resection, histological examination revealed a lesion with pleomorphic cells, cytoplasmic lipidisation, intensely eosinophilic granular bodies, well-delimitated unique nuclei and focal, positive immunoreactivity for synaptophysin, glial fibrillary acidic protein (GFAP), S-100 protein, vimentin and CD56. Once other tumours, such as giant cell metastatic carcinoma or primary lesion like subependymal giant cell astrocytoma, were ruled out, a final diagnosis of XAP was established. After a follow-up period of 9 months, the patient suffered an extensive and local tumour relapse considered inoperable, with progressive neurological deterioration and radiological findings of malignant progression. The brain biopsy procedure revealed anaplastic changes, including necrosis foci, higher mitotic activity (5×10 high-power fields) and a 10% proliferation index measured by Ki67 labelling. The present case showed intraventricular extension and a more aggressive behaviour, both uncommon in these tumours (similar to anaplastic astrocytoma or glioblastoma multiforme), thus demanding an initial, optimal surgical treatment with close clinical and radiological follow-up, due to the high potential for malignant transformation of XAPs.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".