Los autores pretenden evidenciar que los factores pronósticos actuales que intentan evaluar el riesgo de recidiva de los meningiomas atípicos se muestran insuficientes para predecir el devenir de dicha patología.
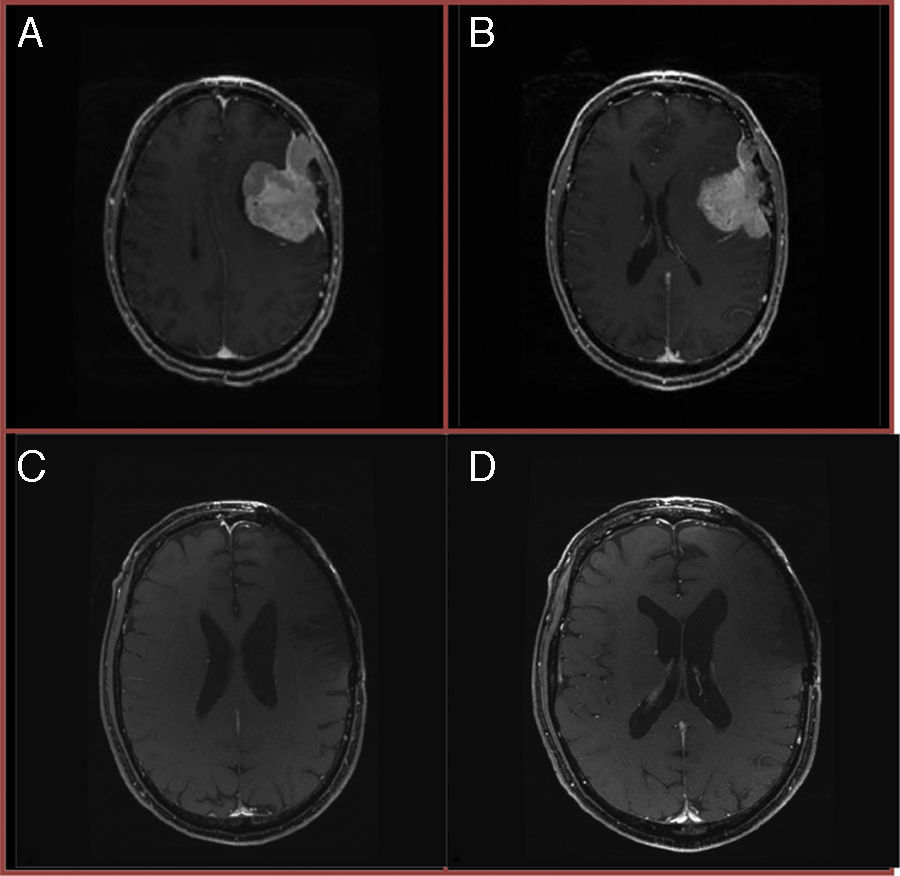
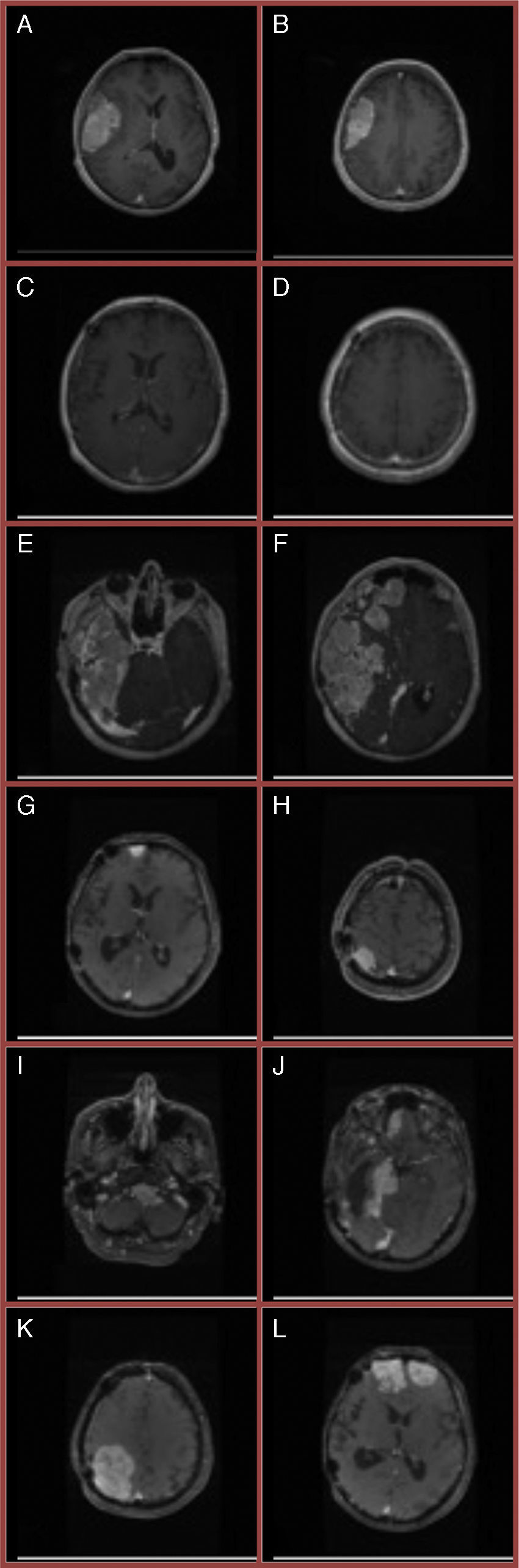
Material y métodoMediante los datos obtenidos de las bases de datos hospitalarias se adquiere una muestra de 27 pacientes con un diagnóstico anatomopatológico de meningioma atípico, con un tiempo mínimo de seguimiento de 6meses tras el diagnóstico. Posteriormente se evalúan los factores pronóstico (edad<50años, sexo masculino, afectación ósea, edema perilesional, volumen tumoral, localización, Ki67/MIB-1) tras la estratificación de los pacientes sometidos a resección completa en recidivantes y no recidivantes. El análisis univariante se realiza mediante test de Mann-Whitney, test χ2 de homogeneidad/test exacto de Fisher. Finalmente se realiza el análisis multivariante mediante regresión logística binaria, obteniéndose los valores correspondientes a la R2 de Nagelkerke y el test de Hosmer-Lemeshow para evaluar la bondad del ajuste.
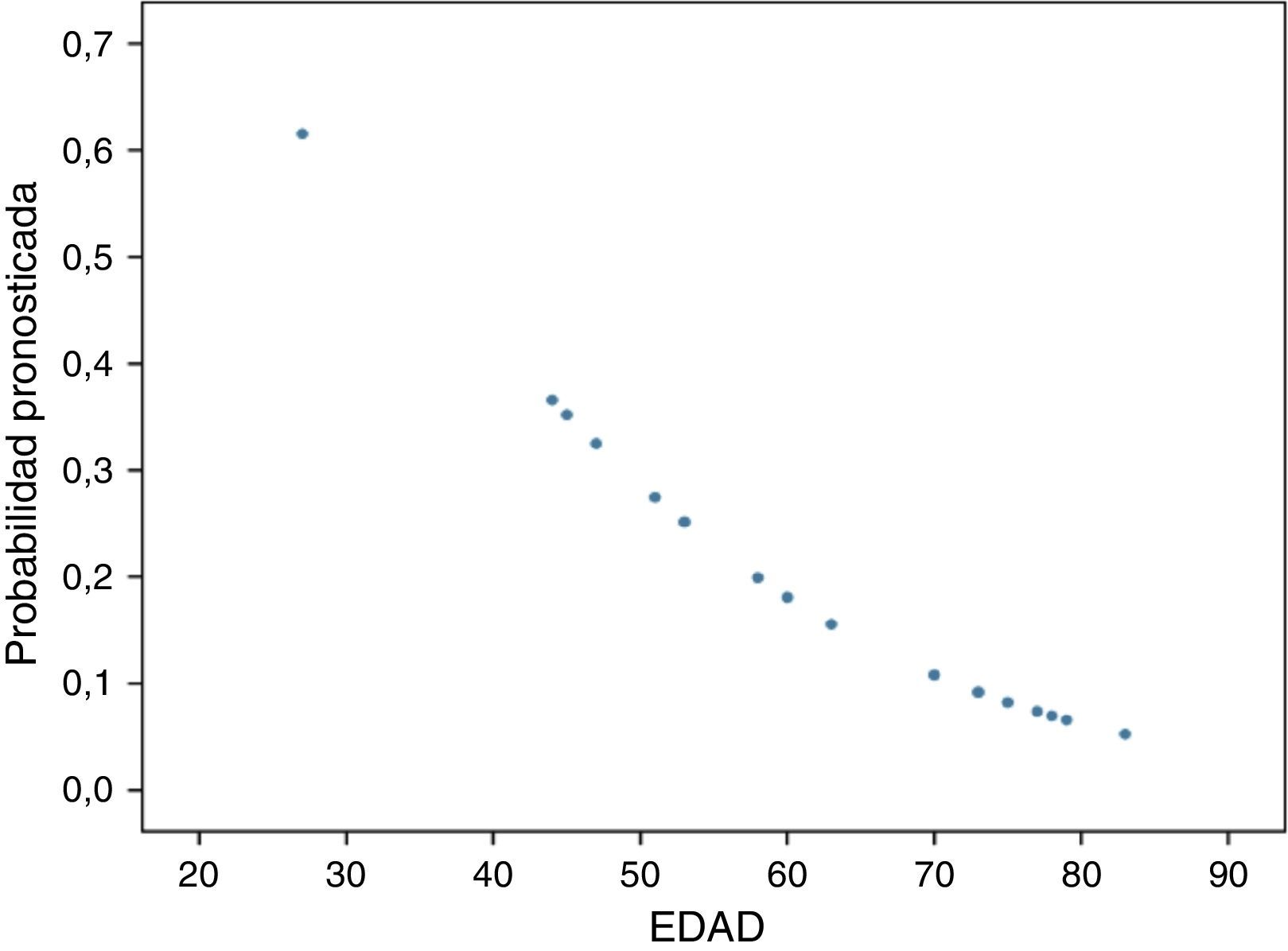
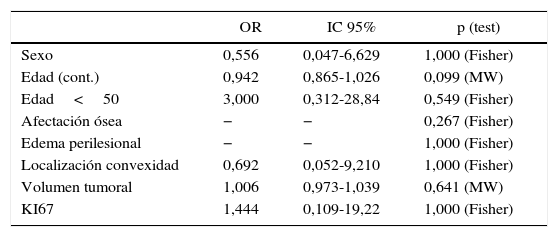
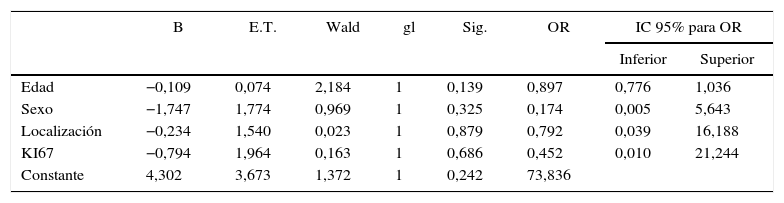
ResultadosLos análisis uni y multivariante no muestran diferencias estadísticamente significativas entre los subgrupos recidivante y no recidivante de los pacientes sometidos a resección completa. Como resultado destacable se objetiva que por cada año de edad por encima de los 50años se disminuye el riesgo de recidiva un 5,8%.
ConclusionesAunque los factores pronósticos actuales puedan mostrar un incremento del riesgo de recidiva una vez se estratifica a los pacientes por los 2 factores más importantes (anatomía patológica y grado de resección), dichos factores se muestran insuficientes para predecir el pronóstico final de los pacientes afectos por dicha patología.
The authors attempt to show how the current prognostic factors that try to assess the risk of recurrence of atypical meningiomas are insufficient to predict the future of this disease.
Materials and methodUsing data obtained from hospital databases, a sample of 27 patients was obtained with pathological diagnosis of atypical meningioma, and who had a minimum follow-up time of 6months after diagnosis. Later prognostic factors (age <50years, male gender, bone involvement, peri-lesional swelling, tumour volume, location, Ki67/MIB-1) were evaluated after the stratification of patients undergoing complete resection in recurrencies and non-recurrencies. Univariate analysis was performed using Mann-Whitney test, χ2 homogeneity test/Fisher exact test. Finally, multivariate analysis was performed using binary logistic regression to obtain the values for R2 Nagelkerke and the Hosmer-Lemeshow to evaluate the goodness of fit.
ResultsThe uni- and multivariate analysis showed no statistically significant differences between recurrent and non-recurrent subgroups of patients undergoing complete resection. It is noted in the results that for each year of age above 50years, the risk of recurrence is decreased by 5.8%.
ConclusionsAlthough current prognostic factors may show an increased risk of recurrence once patients are stratified by the two most important factors (pathology and extent of resection), those factors are insufficient to predict the ultimate outcome of patients affected by this pathology.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora