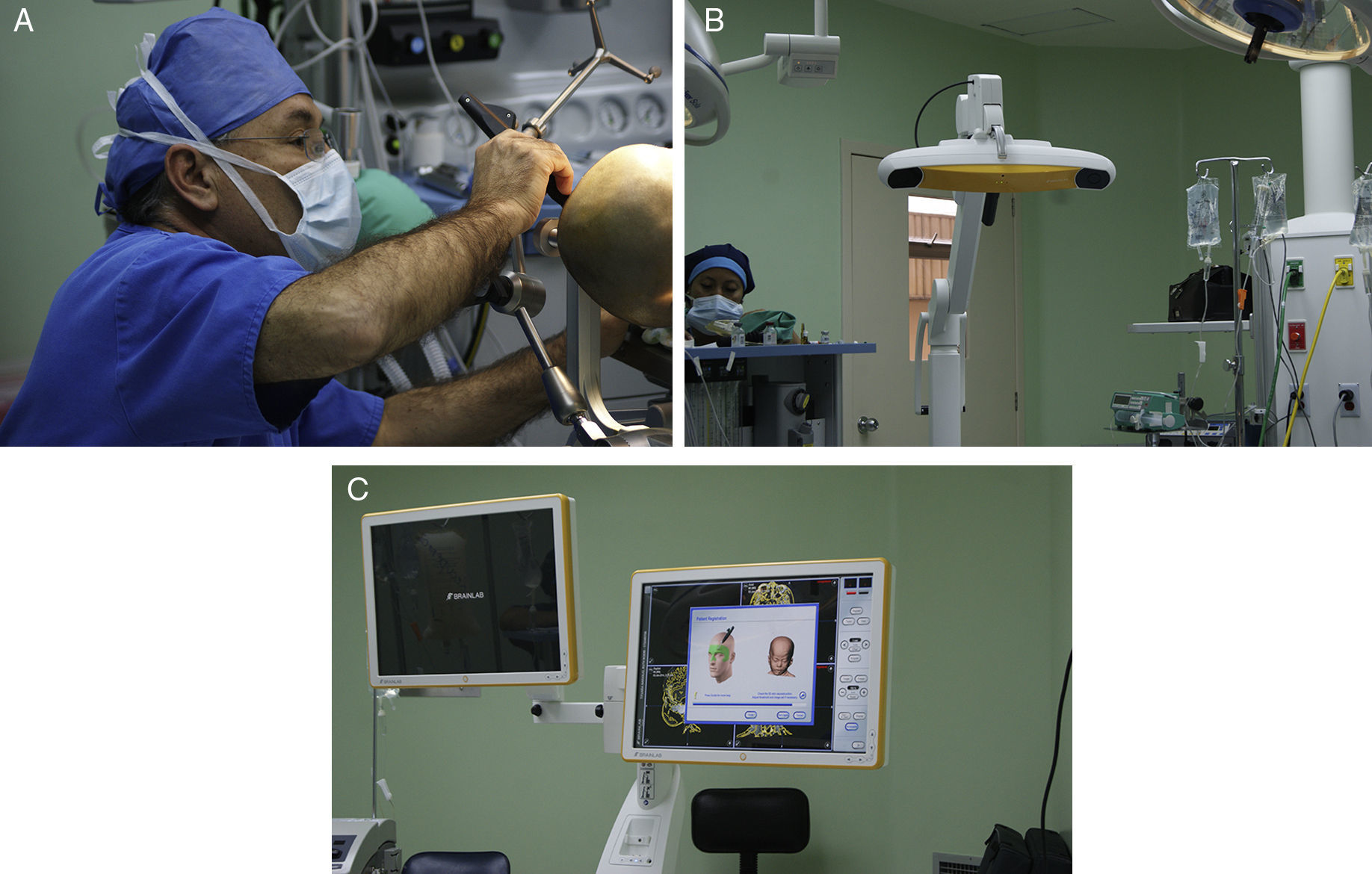
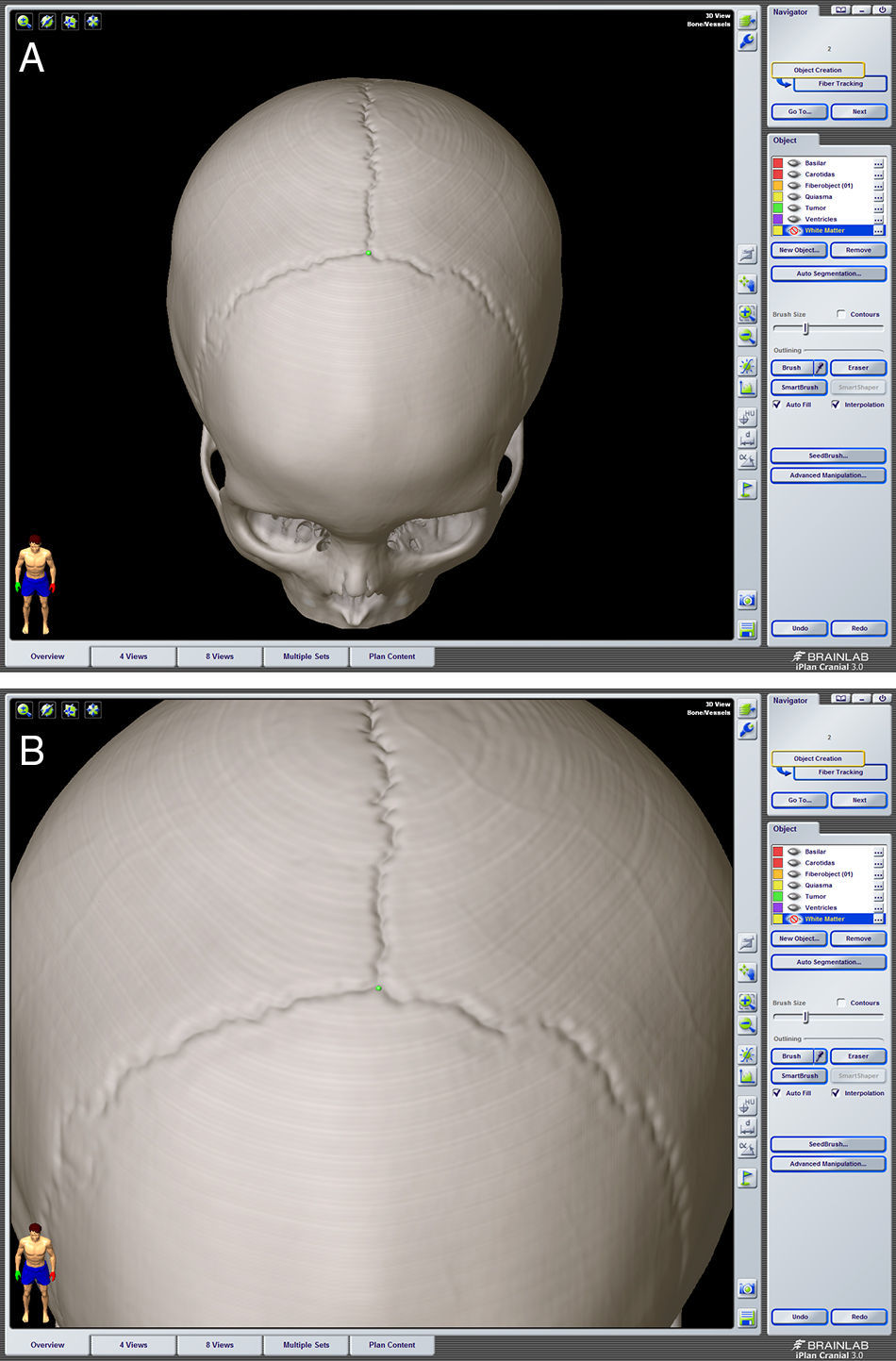
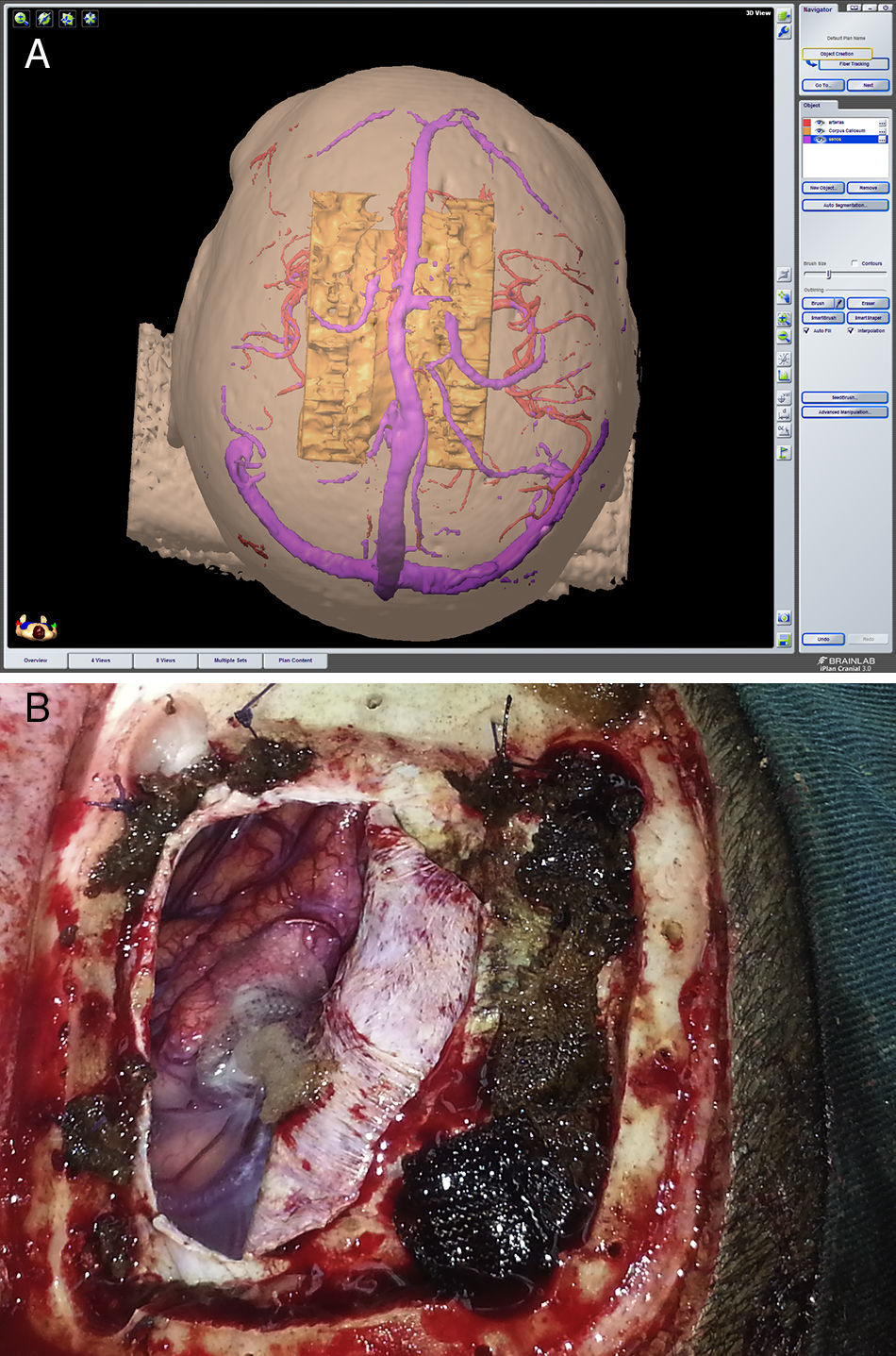
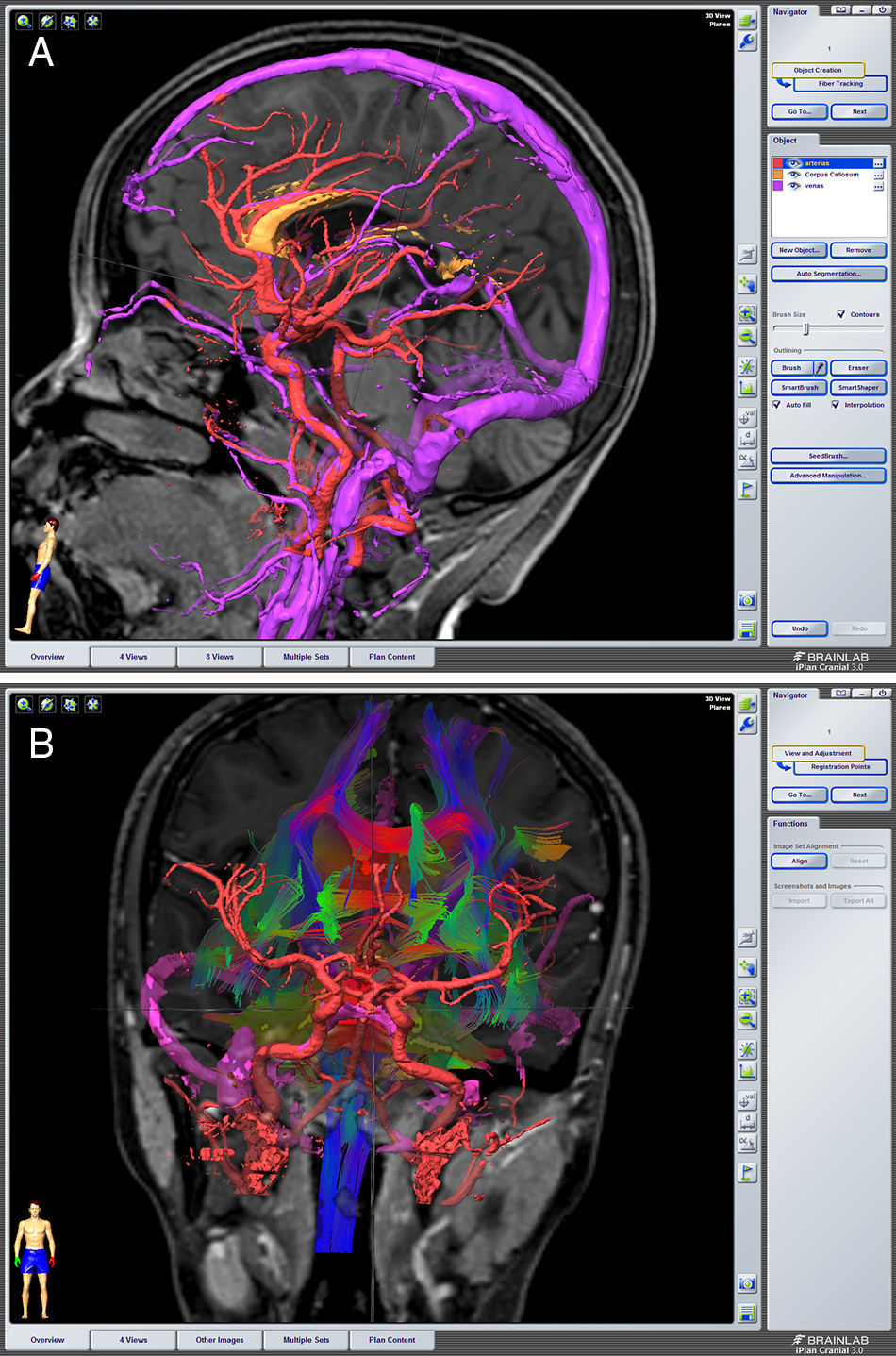
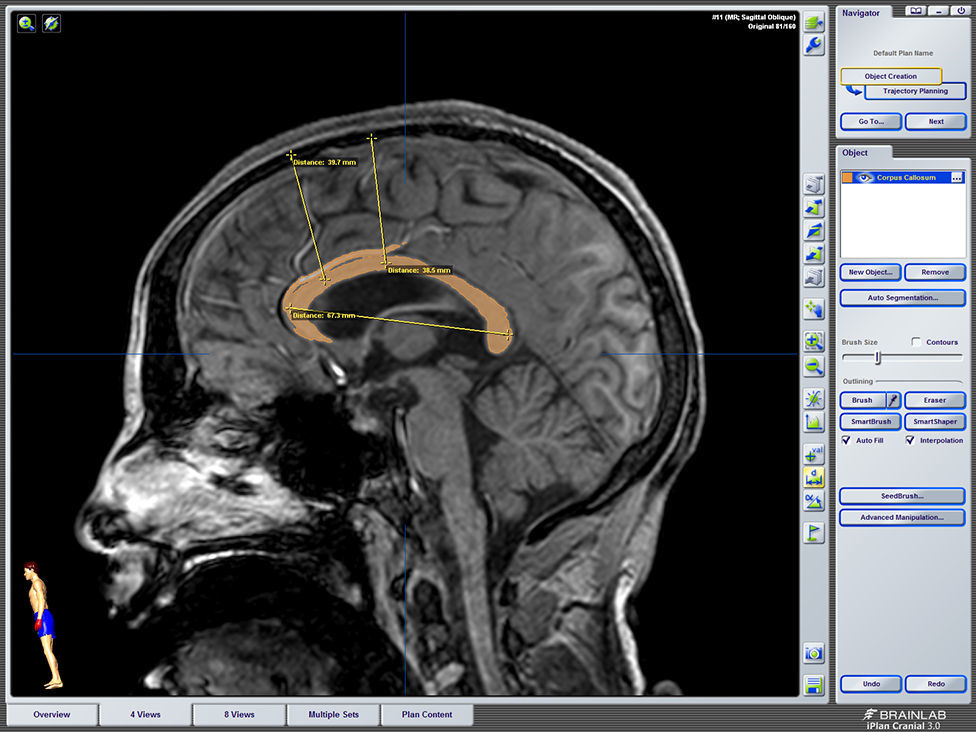
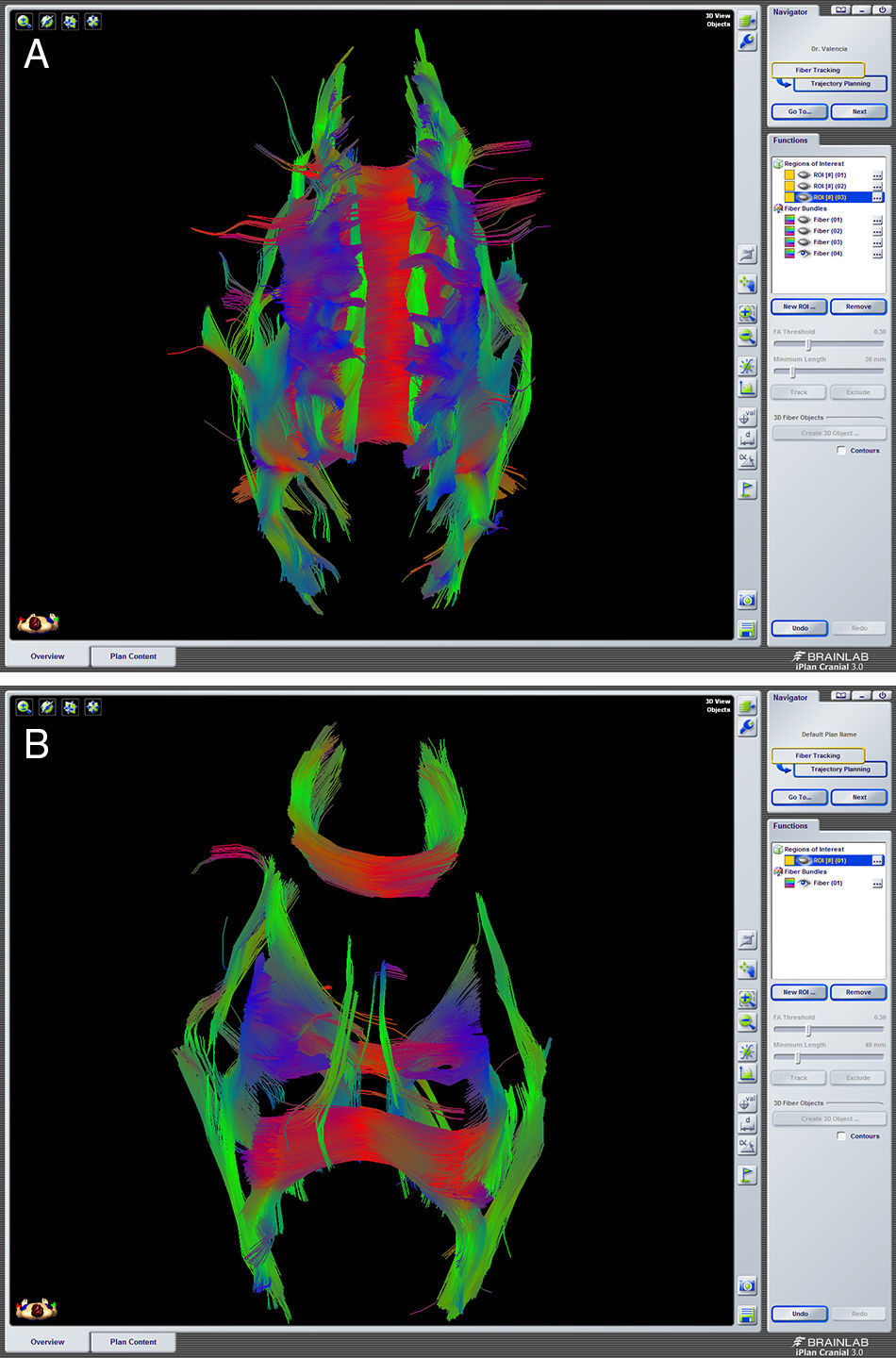
Describir la utilidad de la neuronavegación preoperatoria 3D asistida por ordenador para la localización estereoscópica de los senos venosos, ramas arteriales y cuerpo calloso, para extrapolar las referencias anatómicas sobre el campo quirúrgico y tomar decisiones antes de la intervención.
Materiales y métodosSe realizó un análisis prospectivo de los pacientes con epilepsia refractaria que fueron sometidos a callosotomía asistida por neuronavegación (BRAIN LAB Dual).
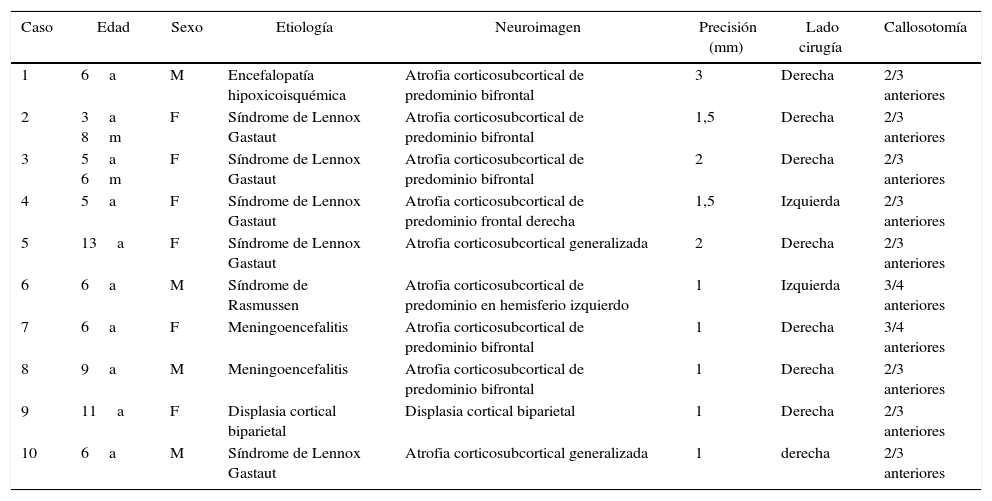
ResultadosEn el año 2014 realizamos 10 callosotomías asistidas por neuronavegación. Las edades de los pacientes (4 varones y 6 mujeres) estuvieron entre 4 y 13 años (promedio 7; SD 3,02). La indicación más frecuente de la callosotomía en nuestra muestra fue el síndrome de Lennox Gastoux (5 pacientes). Realizamos craneotomía parasagital derecha en 8 pacientes. La callosotomía se realizó en los 2/3 anteriores en 8 pacientes y en los 3/4 anteriores en 2 pacientes. La precisión del procedimiento de neuronavegación fue en promedio inferior a 2mm. En ningún caso hubo complicaciones quirúrgicas intraoperatorias significativas.
ConclusiónLa callosotomía guiada por neuronavegación sin marco es una técnica precisa y segura en pacientes con epilepsia refractaria no tributarios de cirugía resectiva.
To describe the usefulness of 3D computer-assisted preoperative neuronavigation for stereoscopic location of the venous sinuses, arterial branches, and corpus callosum, to extrapolate anatomical landmarks on the surgical field and make decisions before the intervention.
MethodsA prospective analysis was performed on patients with refractory epilepsy who underwent neuronavigation-assisted callosotomy (BRAIN LAB Dual).
ResultsA total of 10 neuronavigation-assisted callosotomies were performed in the year 2014. The ages of the patients (4 males and 6 females) were between 4 and 13 years (mean 7; SD 3.02). The most common indication for callosotomy in our sample was Lennox Gastoux (5 patients). A right parasagittal craniotomy was performed in 8 patients. An anterior two-thirds callosotomy was performed in 8 patients and anterior three-quarters in 2 patients. The mean accuracy of the neuronavigation procedure was less than 2mm. In no cases were there significant intraoperative surgical complications.
ConclusionCallosotomy using frameless guided neuronavigation is an accurate and safe technique in patients with epilepsy refractory to surgical resection.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".