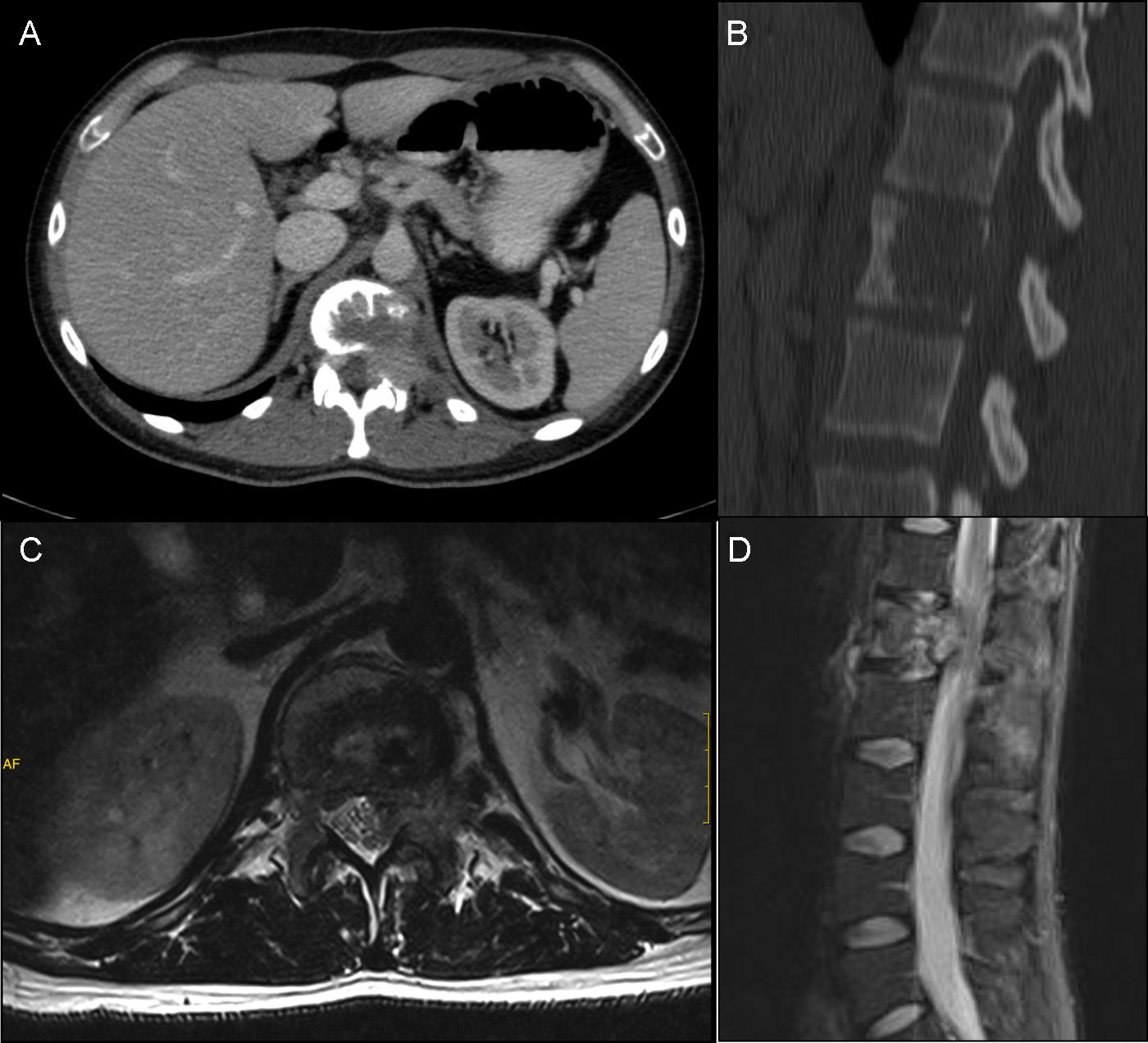
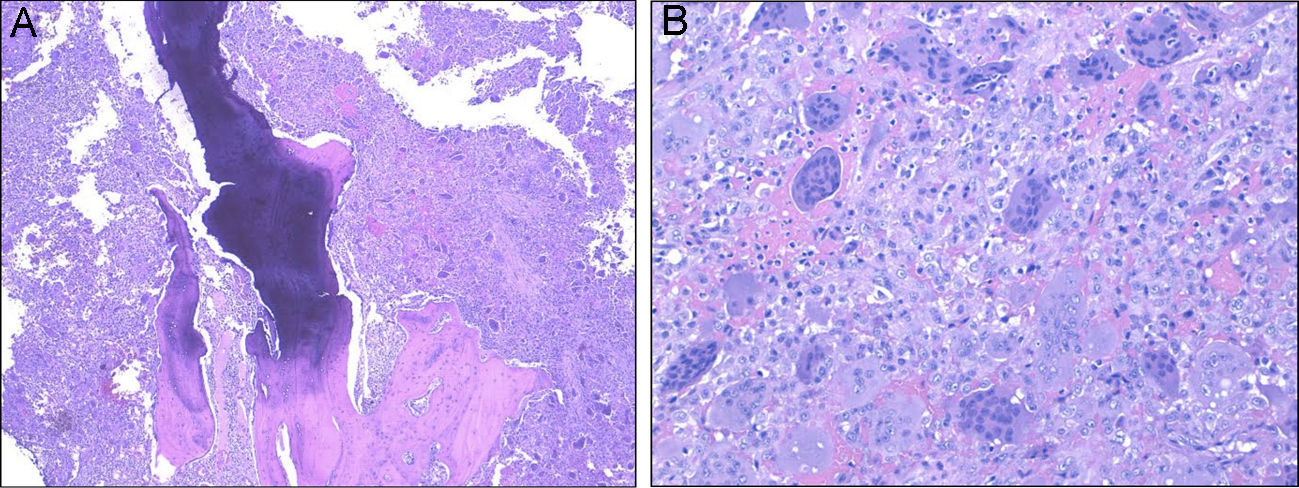
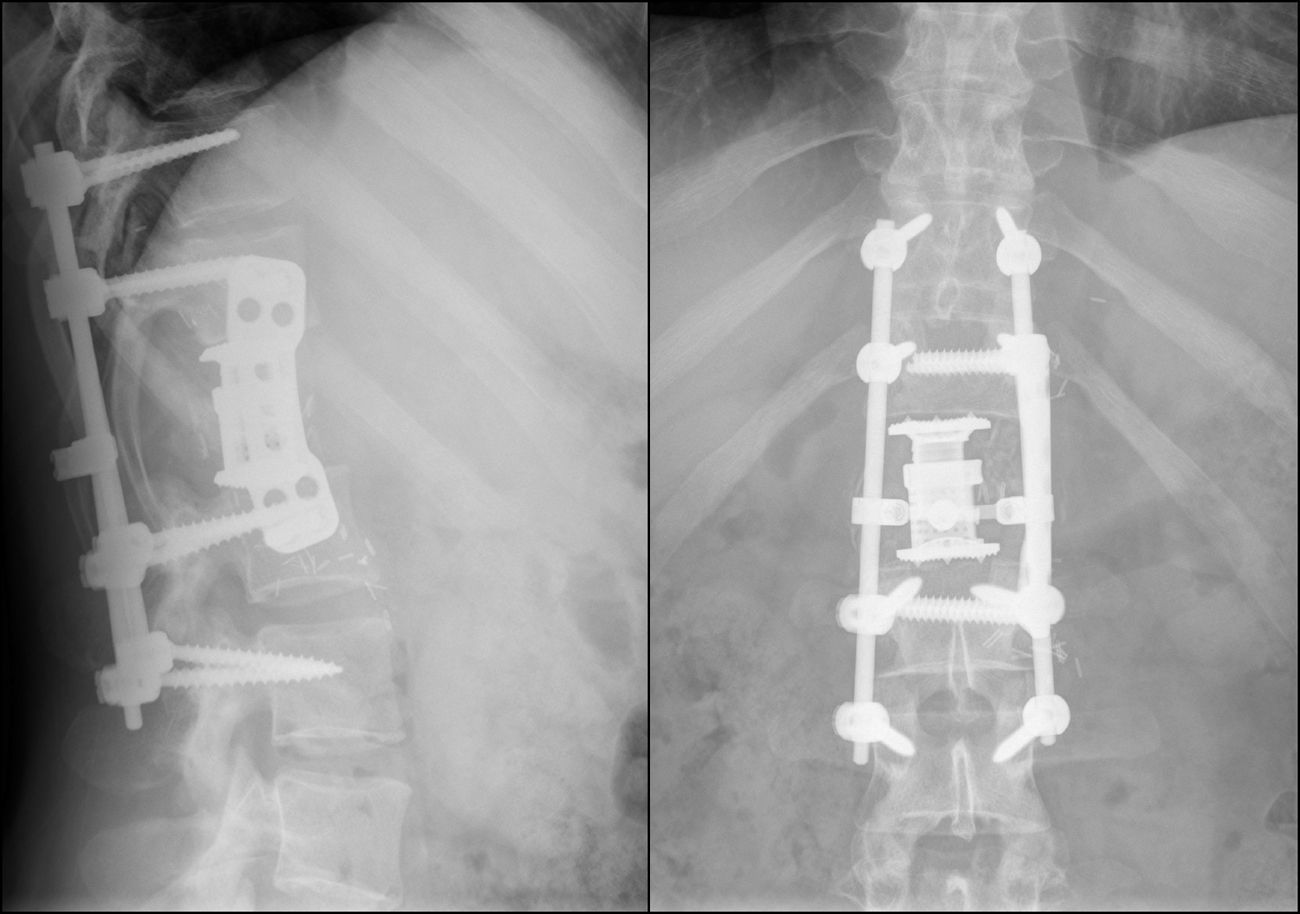
Presentamos el caso clínico de un paciente con dolor lumbar crónico irradiado a muslo izquierdo, diagnosticado por neuroimagen de lesión lítica en cuerpo vertebral de L1. Se realizó biopsia transpedicular que confirmó el diagnóstico de tumor de células gigantes. Fue intervenido quirúrgicamente mediante vertebrectomía L1 e implantación de cilindro de titanio sustitutivo por vía anterior y, a continuación, extirpación de arco posterior de L1 e implante de tornillos pediculares por vía posterior.
El tumor de células gigantes es un tumor óseo primario benigno poco frecuente, de comportamiento agresivo localmente y con potencial capacidad de diseminación a distancia, generalmente a nivel pulmonar. A pesar de afectar más frecuentemente a los huesos largos, alrededor del 10% se localizan en el raquis. Con el objetivo de minimizar el riesgo de recurrencia, el tratamiento de elección es el quirúrgico.
We report the case of a 32-year-old patient complaining of chronic low back pain radiating to his left thigh. His MRI showed a lytic L1 vertebral body injury. A transpedicular biopsy confirmed the diagnosis of giant cell tumor. He underwent a L1 vertebrectomy and vertebral body replacement with a titanium cylinder using anterior approach, followed by the removal of the L1 posterior arch and the placement of pedicle screws through a posterior approach.
The giant cell tumor is a rare benign primary bone tumor that can be locally aggressive and can potentially spread to other areas, usually to the lungs. Although it most frequently affects long bones, approximately 10% of tumors are located in the spine. To minimise the risk of recurrence, the elective management option is surgery.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora