Analizar la modalidad de tratamiento y resultados en una serie clínica de pacientes con neurinomas acústicos gigantes, caracterizados por superar los 4cm de diámetro extrameatal y por alta morbimortalidad.
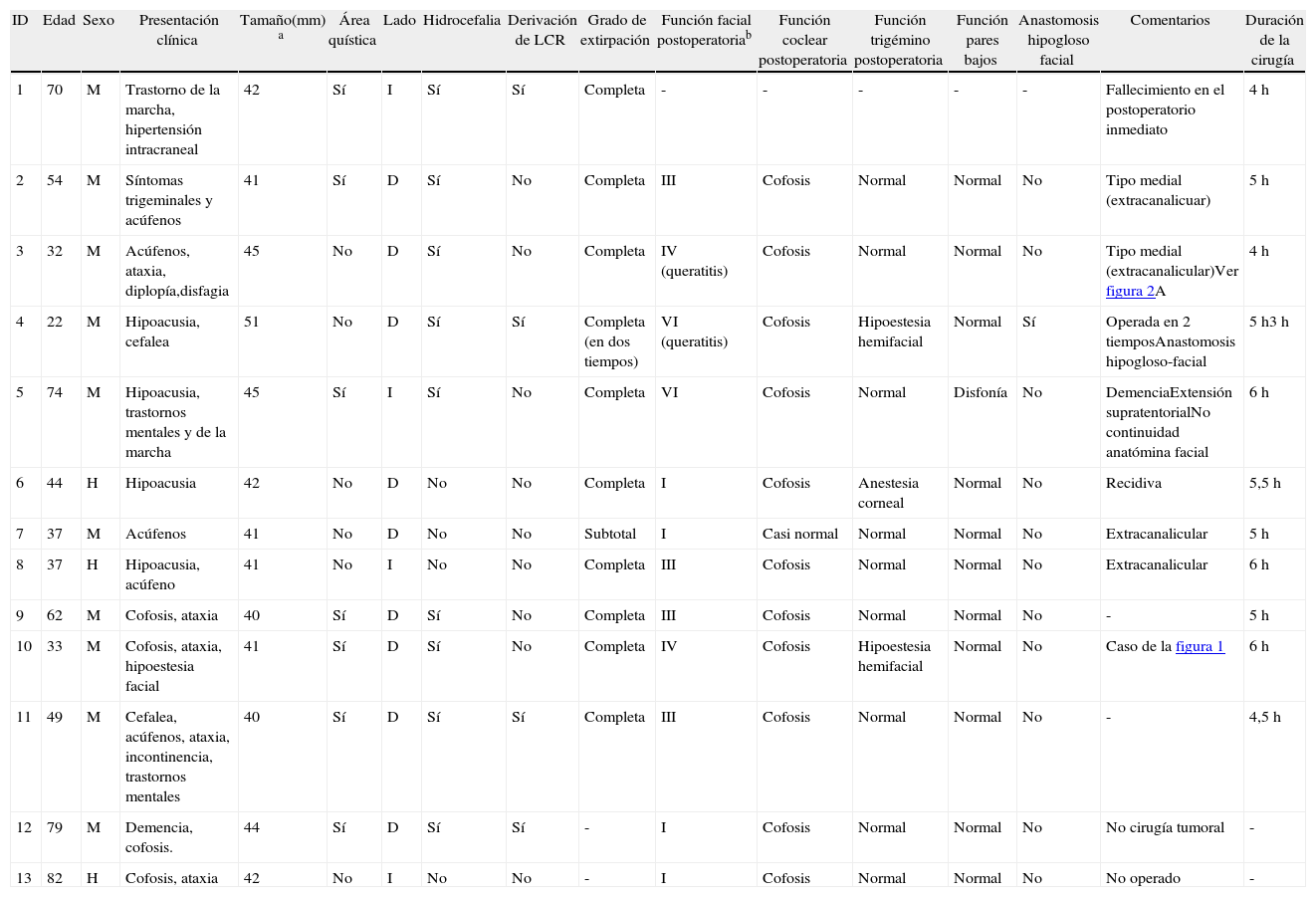
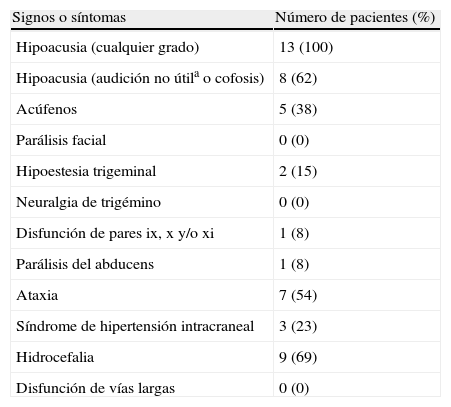
Material y métodoSerie clínica retrospectiva y unicéntrica de schwannomas vestibulares tratados en un periodo de 12 años. En nuestra serie institucional de 108 neurinomas acústicos operados en ese periodo, fueron identificados 13 (12%) pacientes con tumores superiores a los 4cm en su diámetro mayor extrameatal. En estos se analizó la forma de presentación y diversos parámetros clínicos y anatomoquirúrgicos.
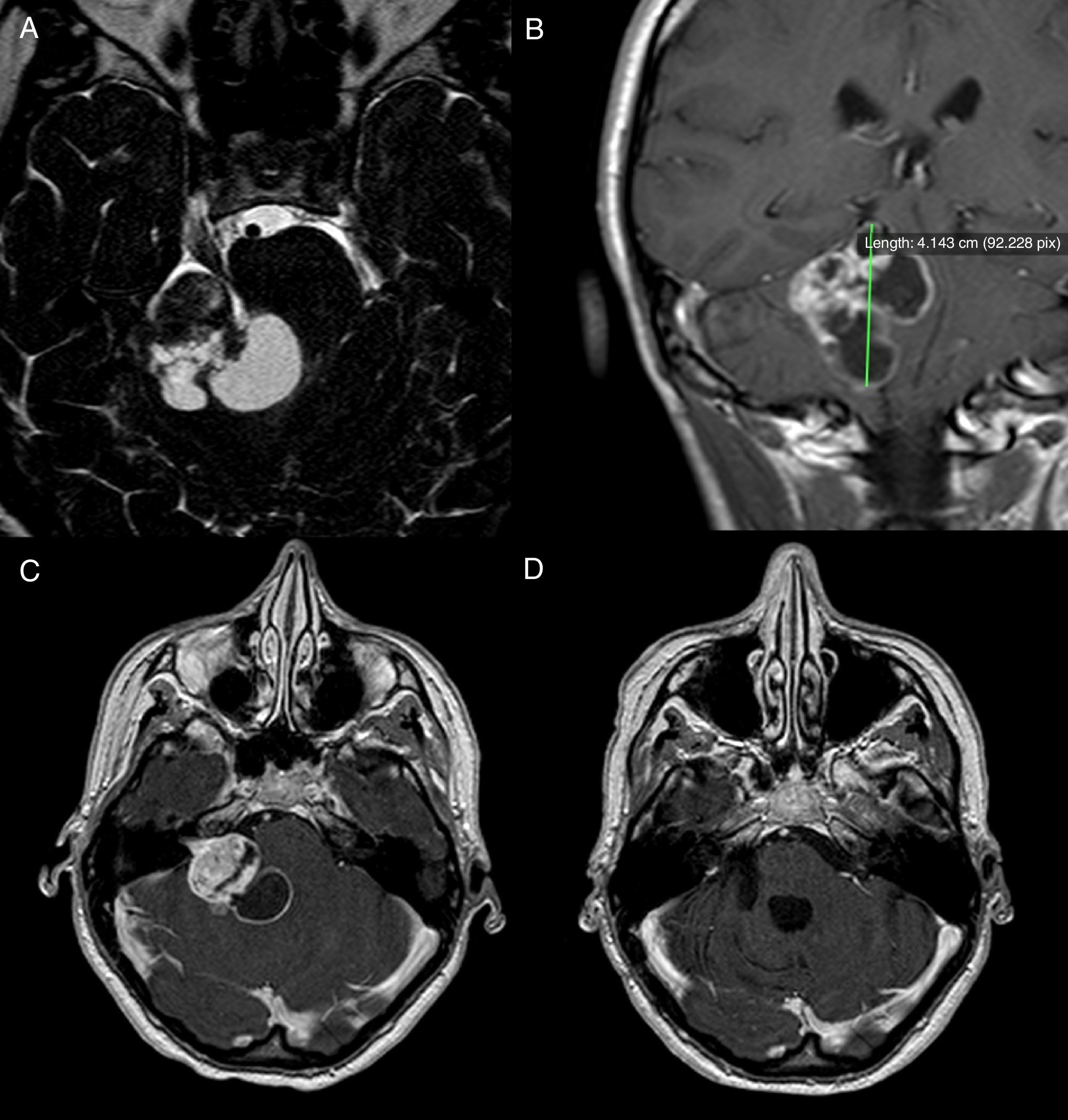
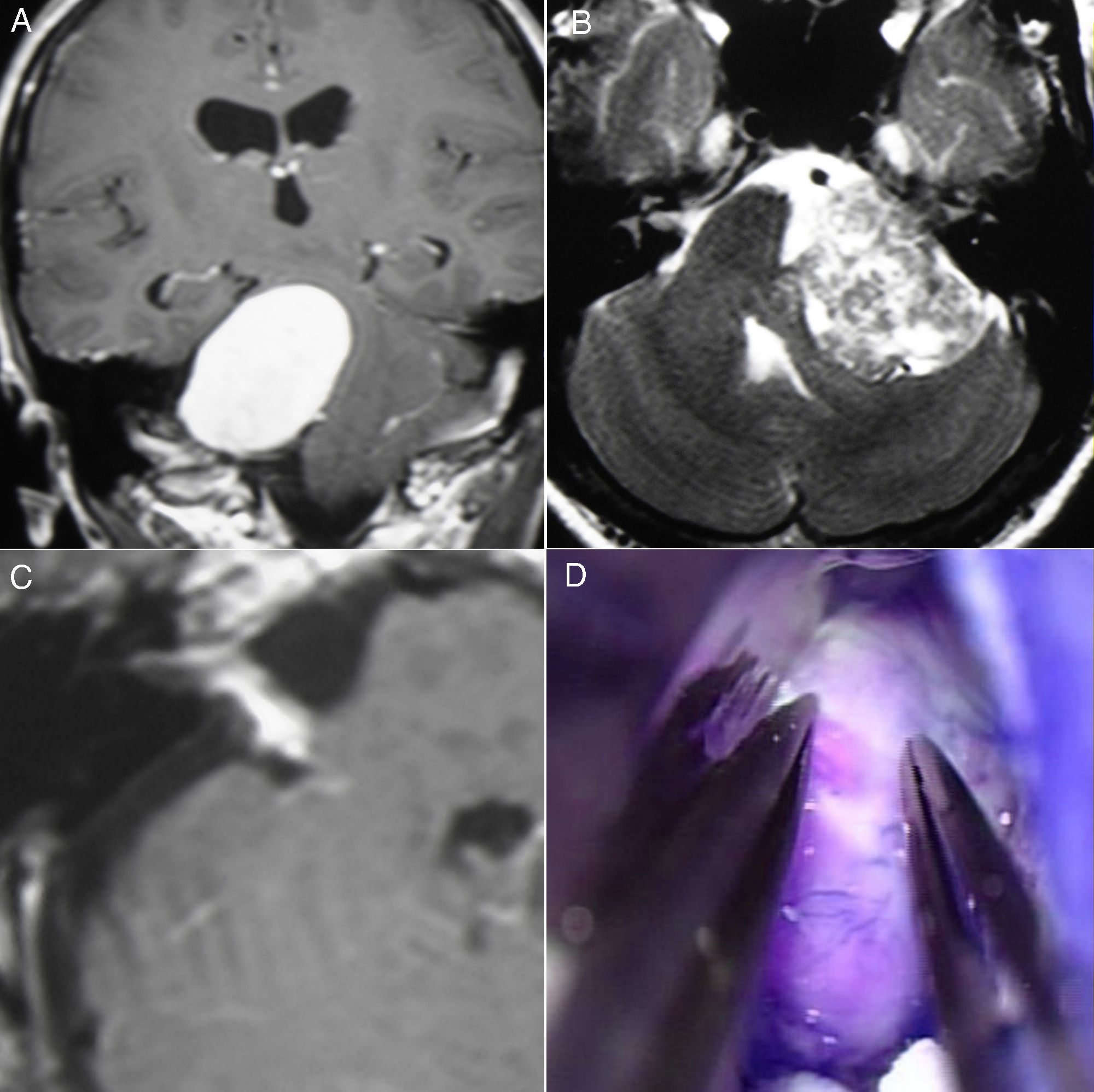
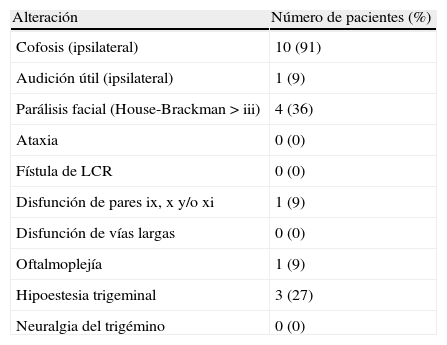
ResultadosTodos los pacientes fueron operados mediante un abordaje suboccipital retrosigmoideo por el mismo neurocirujano (EU) y en 10 casos se consiguió extirpación completa. En un caso se planificó y practicó una extirpación subtotal, un caso fue tratado con derivación ventriculoperitoneal y otro no recibió tratamiento específico alguno. Un paciente falleció durante el postoperatorio inmediato. Cuatro pacientes tenían una parálisis facial mayor de iii en la escala House-Brackman al año de la cirugía.
ConclusionesLas 4 características pronósticas más importantes en los neurinomas acústicos gigantes son: tamaño, consistencia, adhesión a estructuras neurovasculares y vascularización. Solo la primera de ellas resulta evidente en los estudios de neuroimagen.
Los neurinomas acústicos gigantes se caracterizan por alta morbilidad tanto en el momento de presentación clínica como tras el tratamiento. Sin embargo, el objetivo de extirpación completa con preservación de la función de los nervios craneales es alcanzable en algunos casos a través del abordaje suboccipital retrosigmoideo.
To analyze the treatment modality and outcome of a series of patients with giant acoustic neuromas, a particular type of tumour characterised by their size (extracanalicular diameter of 4cm or more) and high morbidity and mortality.
Materials and methodsThis was a retrospective unicentre study of patients with acoustic neuromas treated in a period of 12 years. In our institutional series of 108 acoustic neuromas operated on during that period, we found 13 (12%) cases of giant acoustic neuromas. We reviewed the available data of these cases, including presentation and several clinical, anatomical, and microsurgical aspects.
ResultsAll patients were operated on by the same neurosurgeon and senior author (EU) using the suboccipital retrosigmoid approach and complete microsurgical removal was achieved in 10 cases. In one case, near total removal was deliberately performed, in another case a CSF shunt was placed as the sole treatment measure, and in the remaining case no direct treatment was given. One patient died in the immediate postoperative period. One year after surgery, 4 patients showed facial nerve function of iii or more in the House-Brackman scale.
ConclusionsThe 4 most important prognostic characteristics of giant acoustic neuromas are size, adhesion to surrounding structures, consistency and vascularity. Only the first of these is evident in neuroimaging.
Giant acoustic neuromas are characterised by high morbidity at presentation as well as after treatment. Nevertheless, the objective of complete microsurgical removal with preservation of cranial nerve function is attainable in some cases through the suboccipital retrosigmoid approach.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".