Presentar la experiencia en el tratamiento de la epilepsia resistente a los fármacos mediante estimulación del nervio vago (ENV) en nuestro centro, valorando el impacto de este tratamiento sobre el control de la enfermedad, así como sobre aspectos relacionados con la calidad de vida de los pacientes y de sus cuidadores principales.
Material y métodosSe realizó un análisis retrospectivo de los pacientes implantados desde enero de 2004 hasta diciembre de 2012. Se evaluaron los resultados de encuestas y test completados por los pacientes y sus cuidadores principales.
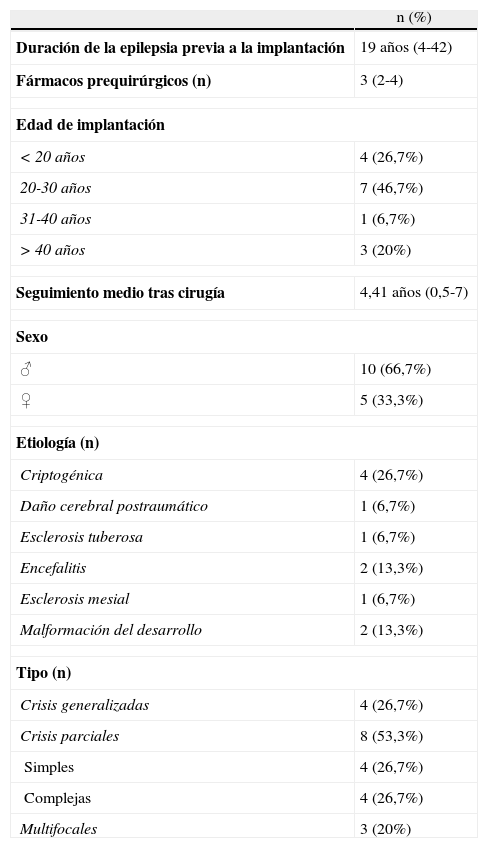
ResultadosSe incluyeron 15pacientes con un seguimiento medio tras la cirugía de 4,41 (0,5-8) años. La edad media en el momento de la cirugía fue de 25 (10-50) años. Más del 66% de los pacientes experimentaron una disminución en la intensidad de las crisis >25%. El 47% presentó una reducción >50% en la frecuencia de las mismas. Como efectos adversos indeseables un paciente presentó disfonía persistente, otro tos y molestias cervicales autolimitados, y otro molestias cervicales. En 2pacientes fue necesaria la explantación por cefalea refractaria al tratamiento médico. No hubo complicaciones derivadas del acto quirúrgico.
ConclusionesLa ENV es un tratamiento efectivo para la reducción del número de crisis y la disminución de la intensidad de las mismas. Tanto los pacientes como sus cuidadores experimentan una mejoría subjetiva de su calidad de vida. Pese a su coste económico, parece reducir en cierto modo la necesidad de cuidados a los pacientes, haciendo su uso justificado.
To present our experience in treating drug-resistant epilepsy with vagal nerve stimulation in our centre, evaluating its impact on disease control and on different aspects related to the patients and main caretakers’ quality of life.
Materials and methodsThis was a retrospective analysis of patients operated from January 2004 until December 2012. Interviews and tests completed by outpatients and principle caretakers were evaluated.
ResultsFifteen patients were included, with a mean postoperative follow-up of 4.41 (0.5-8) years. Mean age at implantation was 25 (10-50) years. Over 66% of the patients perceived a reduction greater than 25% of their crisis intensity. Forty-seven percent of the patients experienced a decrease greater than 50% in the number of crises. As undesired adverse events, one patient presented persistent dysphonia, another self-limited cough and cervical discomfort and another, persistent cervical discomfort. The device had to be removed in 2patients due to refractory headaches. There were no complications derived from the surgical procedure.
ConclusionsVagal nerve stimulation is an effective treatment for reducing crisis frequency and intensity. The patients as well as their caretakers experience a subjective improvement in their quality of life. Despite its economic cost, it seems to reduce their care needs to a certain degree and its use may therefore be justified.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".