La cirugía toracoscópica o torácica videoasistida (VATS) de la región torácica y lumbar ha evolucionado desde su aparición hace menos de 20años y hoy en día puede estar indicada su utilización en una gran cantidad de procesos y lesiones. El objetivo del siguiente trabajo (en sus 2 partes) es hacer una revisión de la situación actual de la VATS de la región torácica y lumbar en todo su espectro.
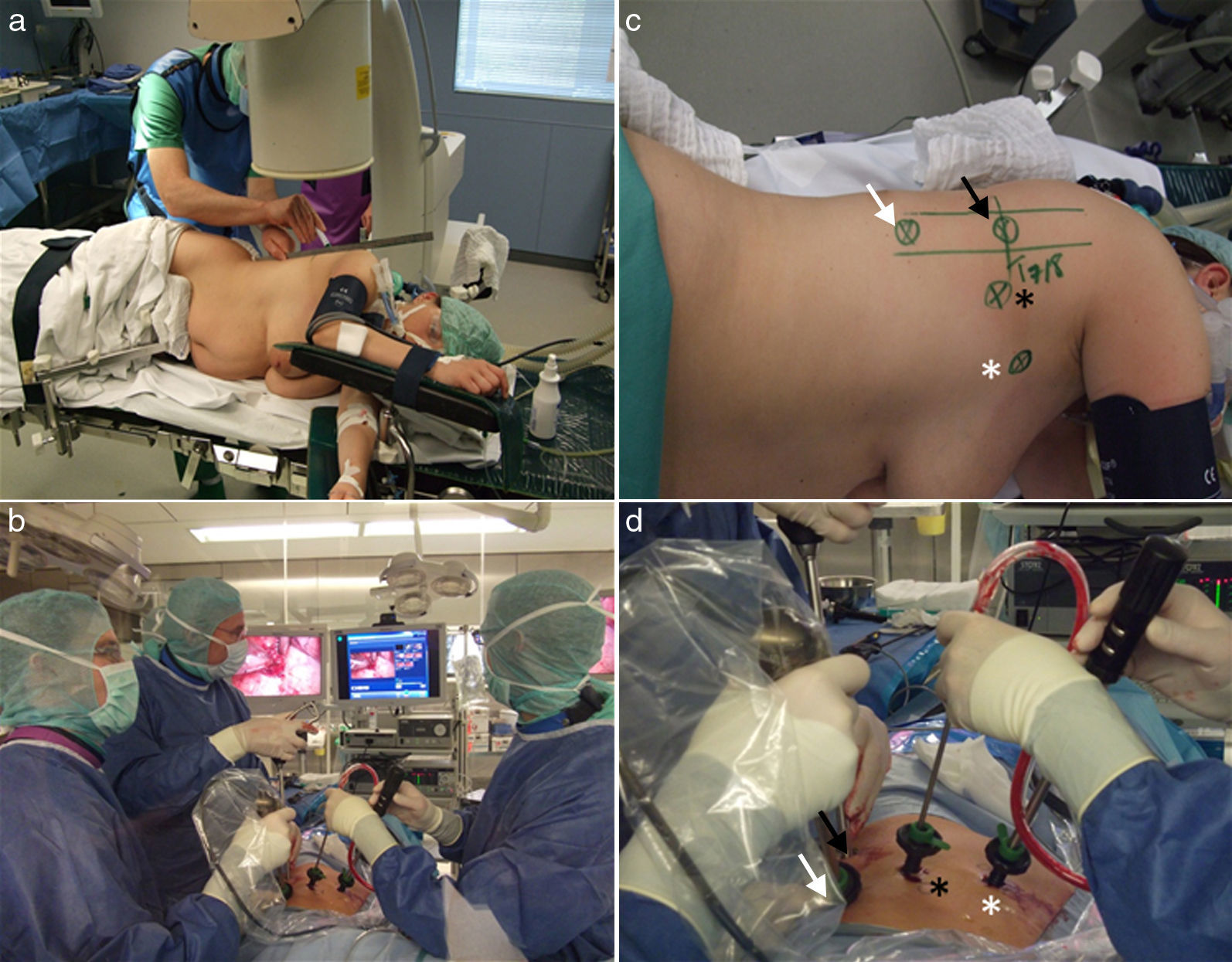
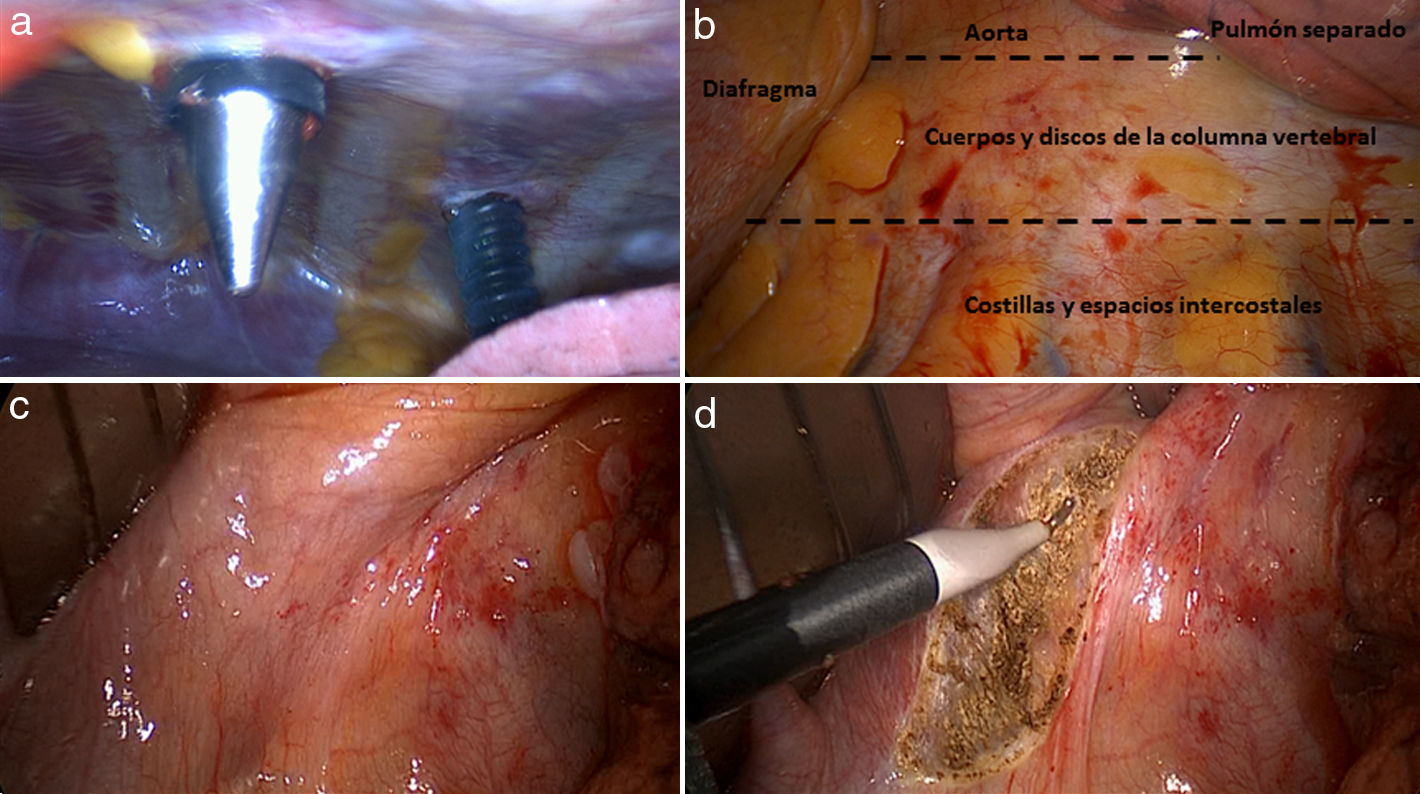
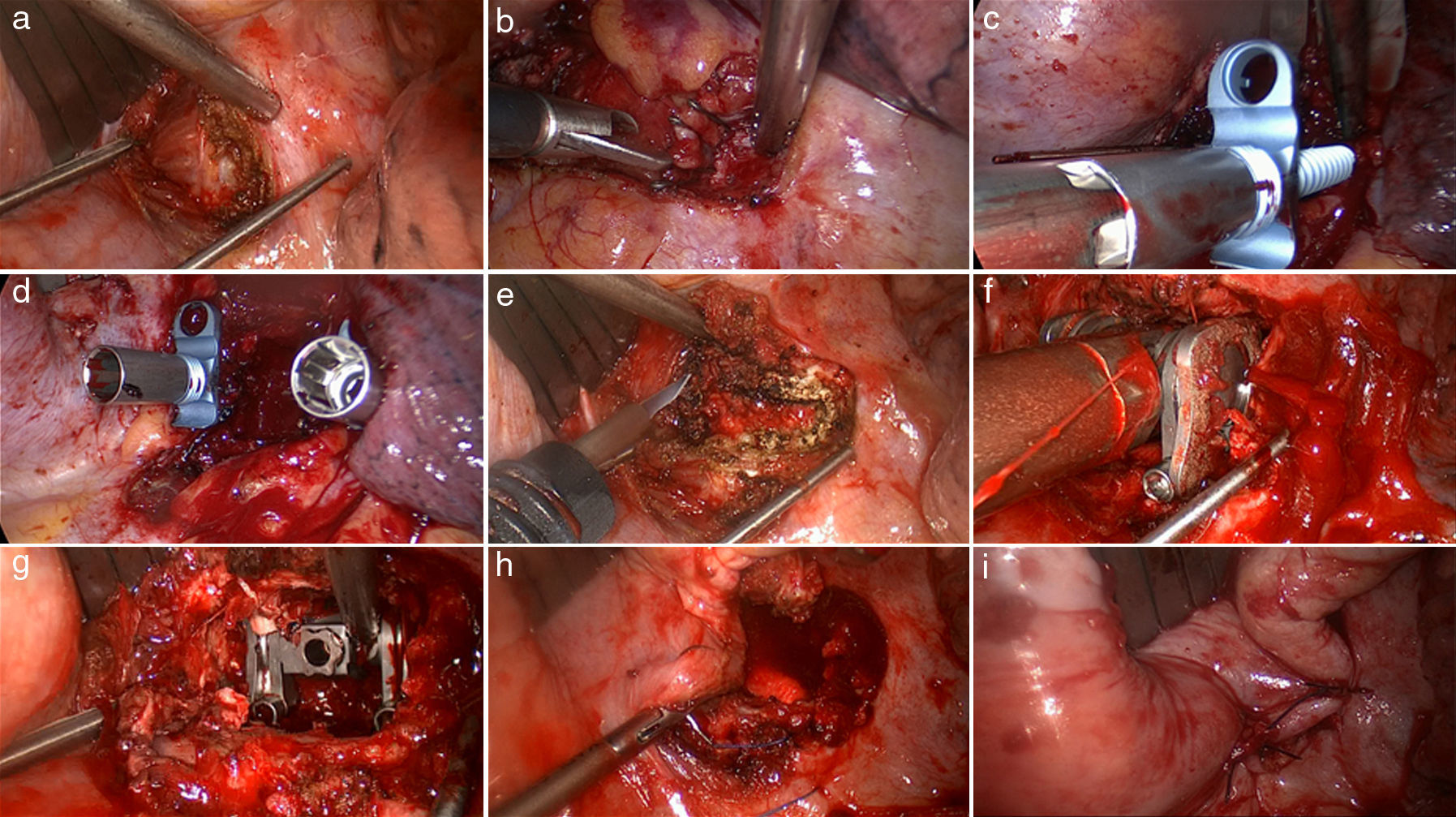
DesarrolloSe realiza una revisión de la literatura desarrollándose uno por uno los grandes grupos de indicaciones donde la VATS tiene lugar. En esta primera parte se realiza una descripción de la técnica quirúrgica general toracoscópica que incluye los requerimientos previos necesarios, el abordaje transdiafragmático, las técnicas utilizadas en la instrumentación y reconstrucción de la columna, y la revisión del tratamiento y de la técnica específica en el manejo de las fracturas raquídeas.
ConclusionesLa cirugía toracoscópica es en muchos casos una alternativa a la cirugía abierta convencional. El uso del abordaje transdiafragmático ha hecho posible el tratamiento toracoscópico de gran cantidad de procesos de la unión toracolumbar. Se ha ampliado el abanico de indicación terapéutica, que incluye el tratamiento de fracturas y deformidades así como la reconstrucción de los segmentos raquídeos lesionados y la descompresión del canal raquídeo si la disposición de la lesión es favorable al abordaje anterolateral. Los buenos resultados clínicos de la VATS están avalados por una creciente experiencia plasmada en un elevado número de trabajos. El grado de complicaciones de la cirugía toracoscópica es comparable al de la cirugía abierta, con ventajas respecto a la morbilidad del abordaje y a la recuperación posterior de los pacientes.
Thoracoscopic surgery or video-assisted thoracic surgery (VATS) of the thoracic and lumbar spine has greatly evolved since it appeared less than 20years ago. Nowadays, it is indicated in a large number of processes and injuries. The aim of this article, in its 2 parts, is to review the current status of VATS in treatment of the thoracic and lumbar spine in its entire spectrum.
DevelopmentAfter reviewing the current literature, we develop each of the large groups of indications where VATS is used, one by one. This first part contains a description of general thoracoscopic surgical technique including the necessary prerequisites, transdiaphragmatic approach, techniques and instrumentation used in spine reconstruction, as well as a review of treatment and specific techniques in the management of spinal fractures.
ConclusionsThoracoscopic surgery is in many cases an alternative to conventional open surgery. The transdiaphragmatic approach has made endoscopic treatment of many thoracolumbar junction processes possible, thus widening the spectrum of therapeutic indications. These include the treatment of fractures and deformities, as well as the reconstruction of injured spinal segments and decompression of the spinal canal in any etiological processes if the lesion placement is favourable to antero-lateral approach. Good clinical results of thoracoscopic surgery are supported by the growing experience reflected in a large number of articles. The degree of complications in thoracoscopic surgery is comparable to open surgery, with benefits in morbidity of the approach and subsequent patient recovery.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora