Analizar los resultados de la cirugía resectiva en los pacientes en los que fue posible la identificación de un foco epileptogénico frontal después de una callosotomía.
Material y métodosFueron revisados prospectivamente los datos de los pacientes con epilepsia resistente a los fármacos que persistían con crisis incapacitantes tras la callosotomía y fueron tratados posteriormente con cirugía resectiva sobre el lóbulo frontal. Fue evaluada la clasificación según la escala de Engel antes y después de cada cirugía y el porcentaje de reducción de crisis. Adicionalmente se evaluó la satisfacción de los familiares.
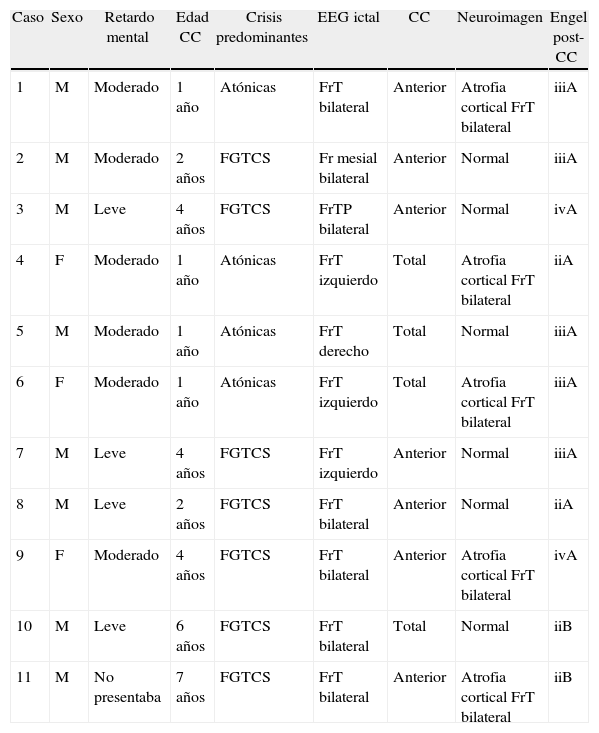
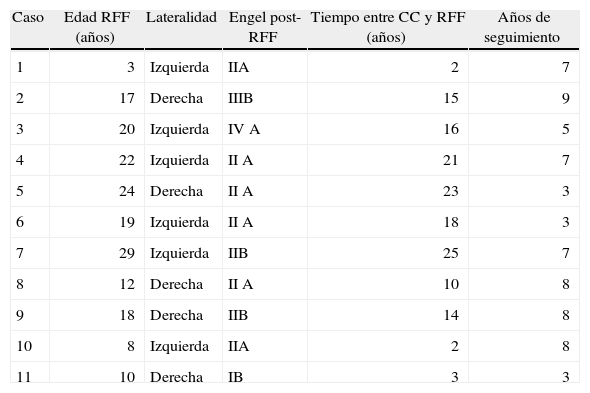
ResultadosFueron identificados 11 pacientes. Tras una mediana de seguimiento de 7 años (RIC, 3-8 años), el 63,6% de los pacientes demostraron mejoría de las crisis según la clasificación en la escala de Engel, el 27,2% permanecieron sin cambios y uno empeoró. Un paciente se catalogó en clase i, 8 en clase ii, uno en clase iii y uno en clase iv. A su vez, el porcentaje de reducción del número de crisis fue mayor del 90% en el 54,5% de los pacientes; entre el 50 y el 90% en el 36,4%, y menor del 50% en el 9,1%. La satisfacción de los familiares fue calificada como buena o excelente en el 90,9% de los casos.
ConclusionesAdemás de disminuir las crisis, la callosotomía constituye una herramienta diagnóstica que permite la identificación de potenciales dianas de cirugías resectivas y, por tanto, debe ser especialmente considerada cuando se sospecha que existen focos epileptogénicos frontales que podrían ser tratados quirúrgicamente.
To analyse the results of resective surgery in patients in whom it was possible to identify a frontal epileptogenic focus through corpus callosotomy.
Material and methodsData from patients suffering drug-resistant epilepsy showing persistence of disabling seizures after undergoing corpus callosotomy and subsequent treatment with frontal lobe resective surgery were prospectively reviewed. Classifications according to Engel's scale before and after each intervention were evaluated, as were the percentages of seizure reduction. Additionally, the satisfaction of family members with surgical outcomes was also assessed.
ResultsEleven patients were identified. After a median follow-up period of 7 years (IQR: 3-8 years), 63.6% of patients showed improvement of seizures according to Engel's scale, 27.2% remained unchanged and one worsened. One patient was categorised as class i, 8 as class ii, one as class iii and one as class iv. The percentage reduction in the number of seizures was over 90% in 54.5% of patients, between 50% and 90% in 36.4% and less than 50% in 9.1%. Family satisfaction was reported as good or excellent in 90.9% of cases.
ConclusionsIn addition to providing better seizure control, corpus callosotomy also appears to be a diagnostic tool allowing the identification of potential targets for resective surgery. Therefore, it should be considered upon suspicion of a frontal epileptogenic focus which could be surgically treated.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".