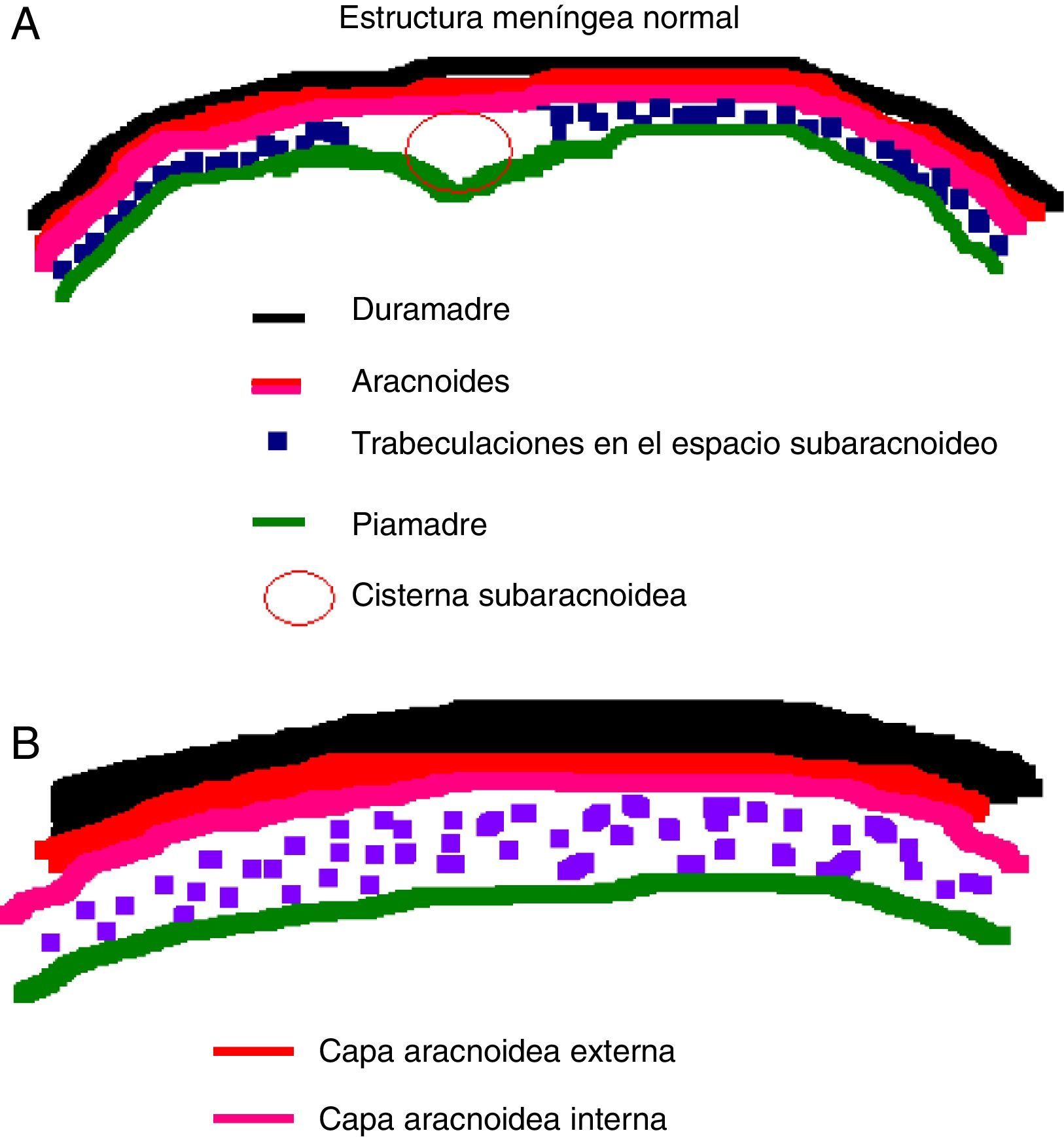
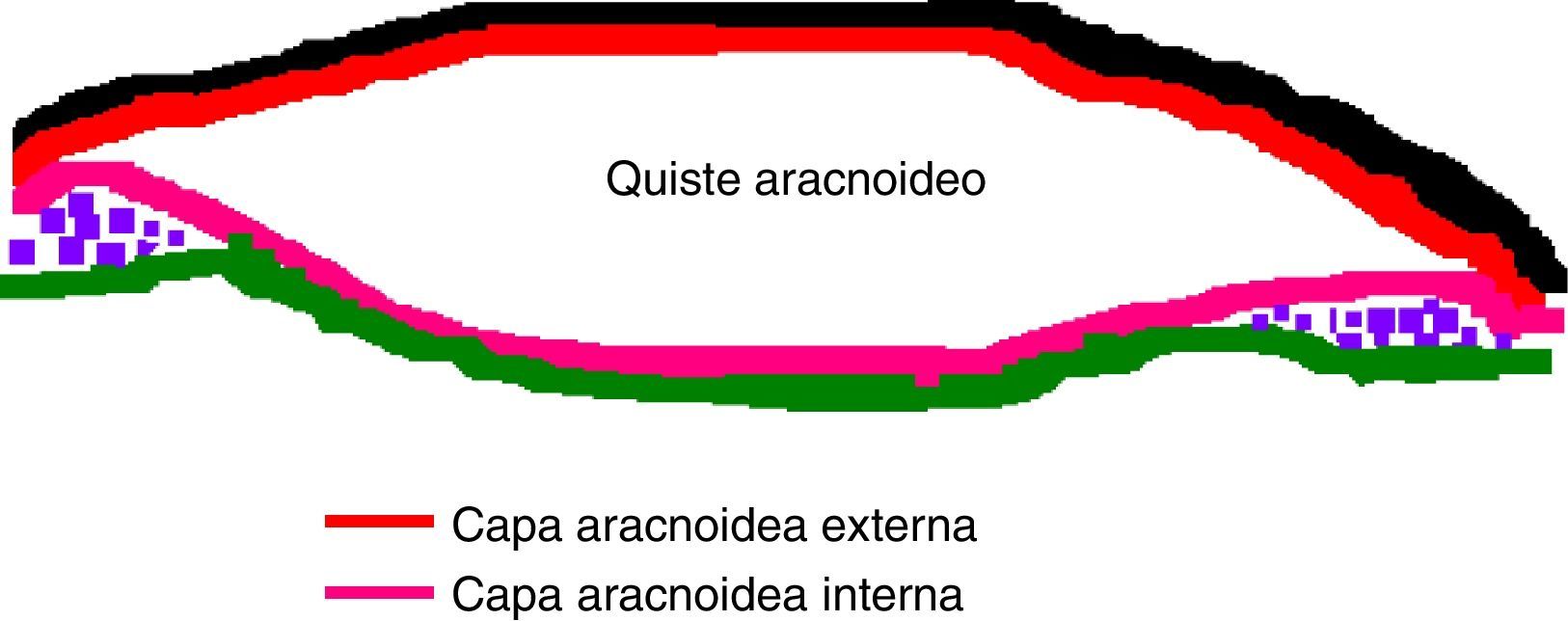
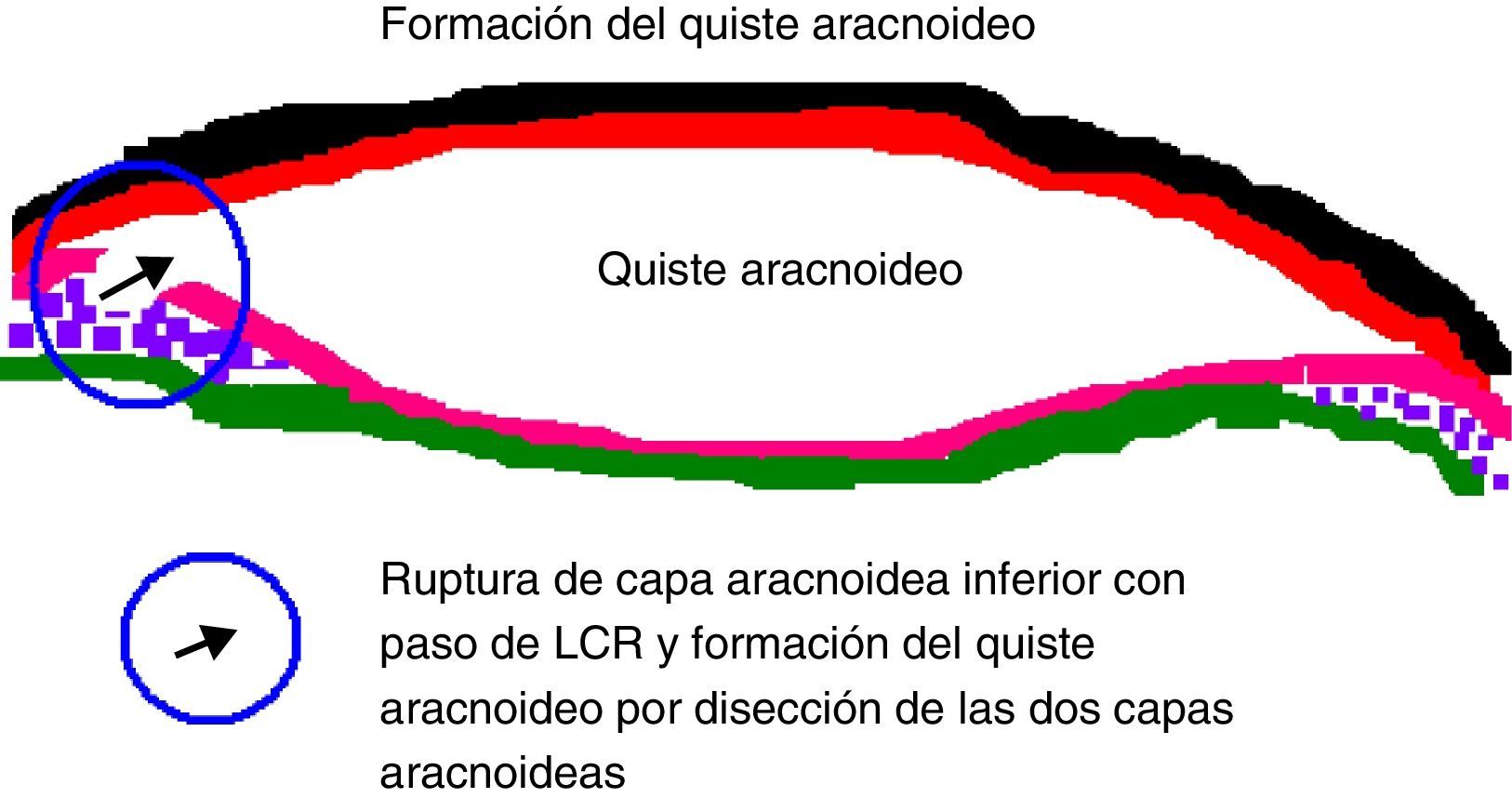
Existe en la actualidad todavía mucha controversia en cuanto al origen de los quistes aracnoideos. En el caso de los quistes aracnoideos congénitos, la teoría más aceptada es aquella que explica cómo se forman a partir del desarrollo anómalo de la membrana aracnoidea, la cual se desdobla facilitando la acumulación de líquido cefalorraquídeo en su interior, dando lugar a un quiste. Esta teoría parece explicar el origen de los quistes aracnoideos de convexidad y silvianos, mientras que aquellos en otras localizaciones podrían ser debidos a otras causas. En el estudio anatomopatológico se aprecia que la pared de los quistes aracnoideos difiere poco de la membrana aracnoidea normal, pudiendo estar engrosada debido a un aumento de depósito de material colágeno.
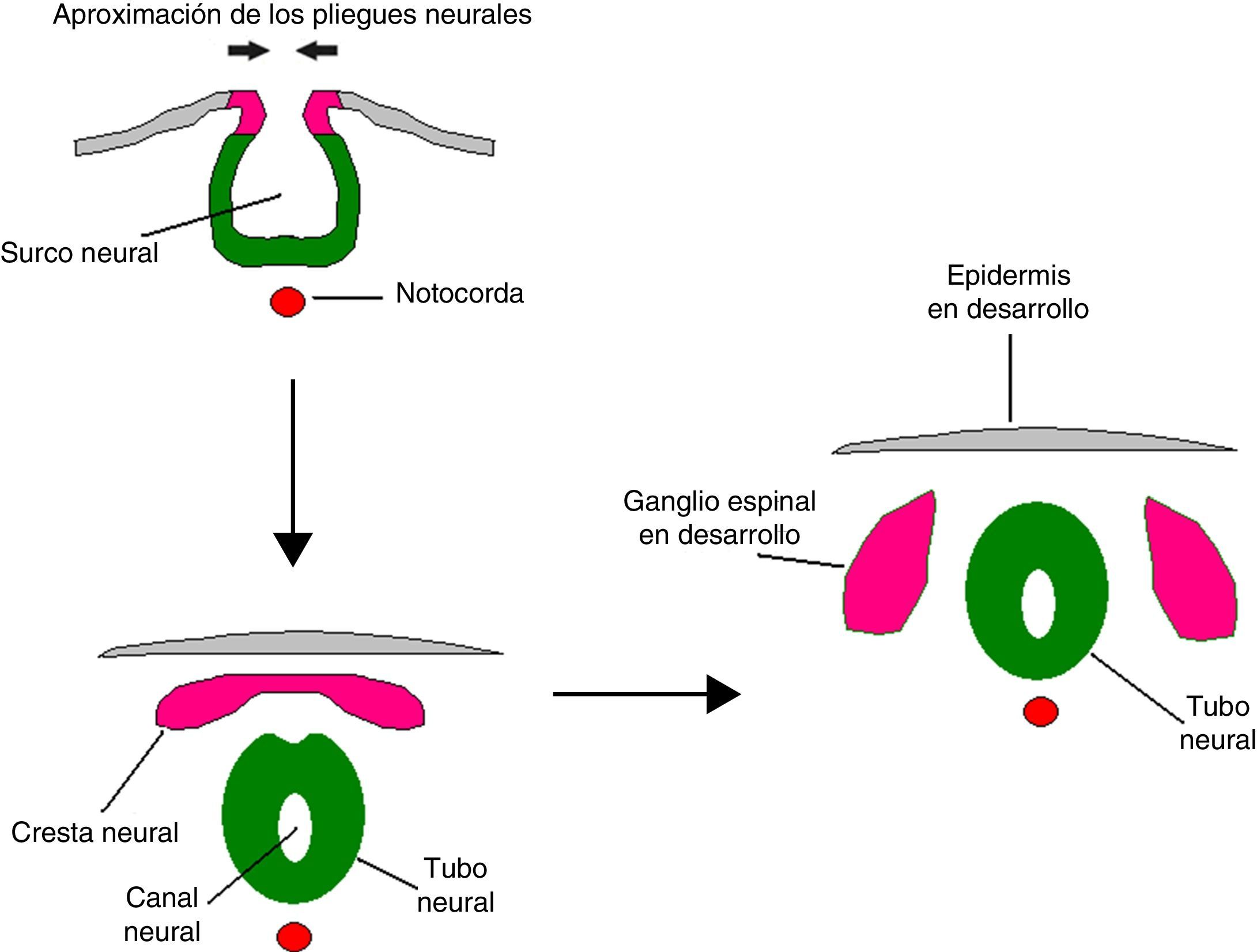
Exponemos el desarrollo embriológico normal de la aracnoides, las alteraciones que se producen en dicho desarrollo y que condicionan la formación de los quistes aracnoideos describiendo sus hallazgos anatomopatológicos más característicos.
There is still great controversy surrounding the origin of the arachnoid cyst. The most accepted theory in the case of congenital cysts explains how they are formed from an anomalous development of the arachnoid membrane, which is unfolded allowing the accumulation of cerebrospinal fluid inside and creating a cyst. This theory seems to explain the origin of convexity and sylvian cistern arachnoid cysts, whereas those in other locations might be due to other mechanisms. In the anatomopathological analysis, the arachnoid cyst wall can be seen as having few differences from normal, although thickened due to an increase quantity of collagenous material.
A description of the embryological development of the arachnoid layer and cyst formation is presented, describing the main anatomopathological findings.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora