Hasta hace poco la inervación del disco intervertebral fue objeto de debate.
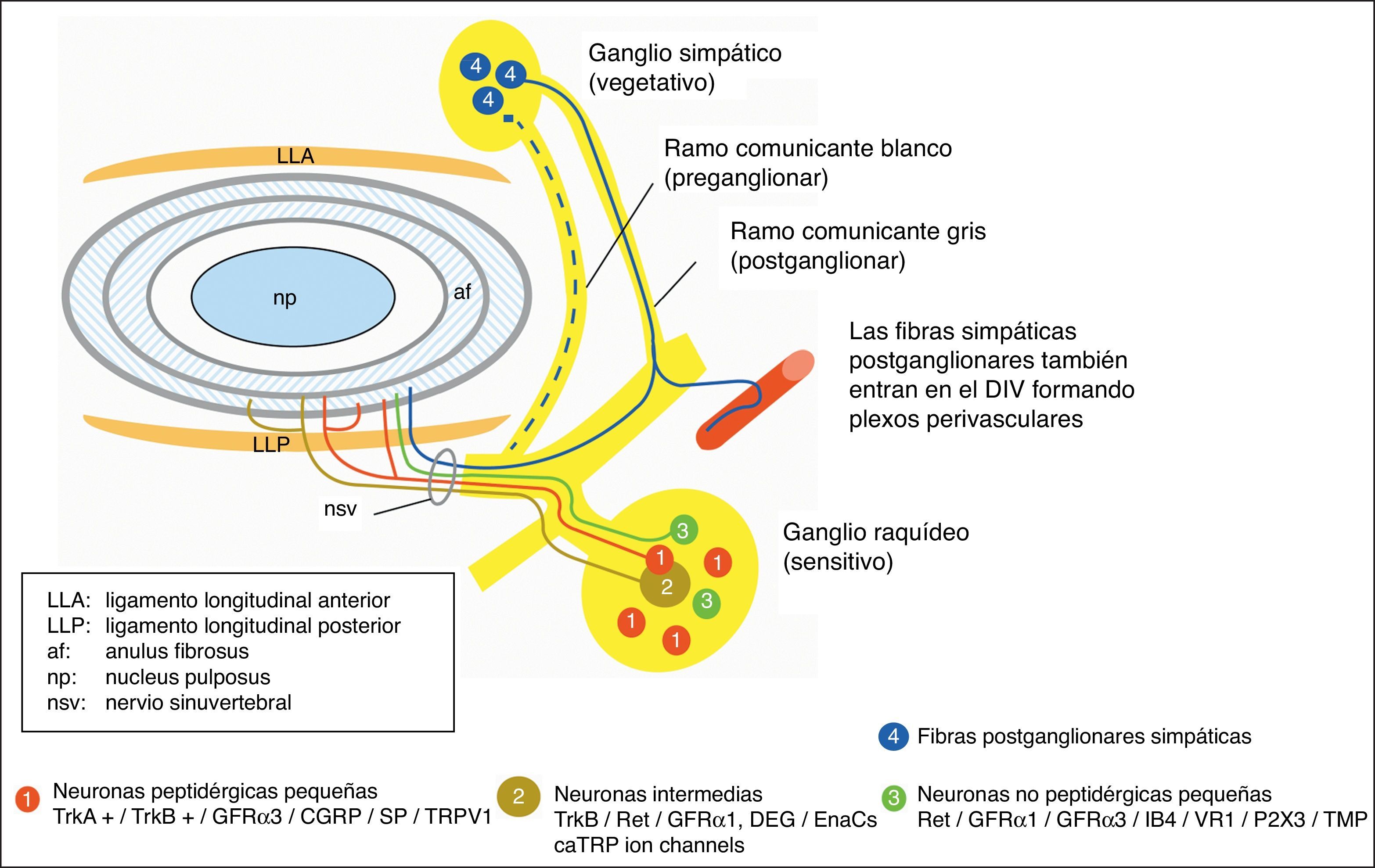
La introducción de técnicas de inmunohistoquímica asociadas a anticuerpos específicos y los estudios con trazadores nerviosos retrógrados han permitido conocer mejor la inervación del disco en condiciones normales y patológicas así como las características de las terminaciones y sus patrones de distribución en ambas situaciones. Las controversias que existen acerca de las bases estructurales del dolor discogénico han despertado el interés por conocer la influencia de la inervación en el dolor lumbar de origen discal y sus características.
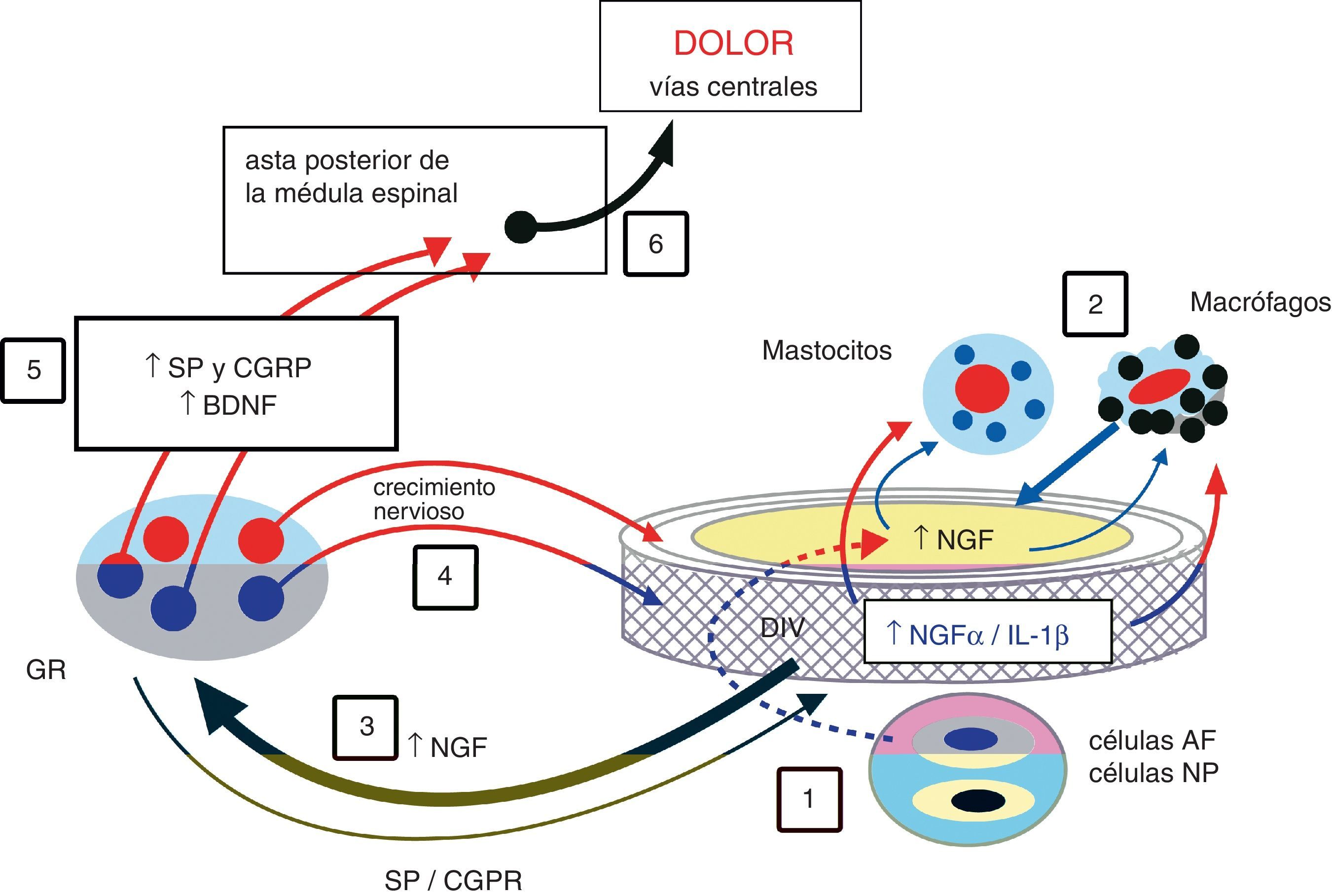
Actualmente sabemos que la neoinervación patológica de las fisuras radiales es un factor importante en la génesis del dolor discogénico dentro de un complejo mecanismo en que están implicados factores neurobioquímicos, inflamatorios y biomecánicos.
Until very recently, intervertebral disc innervation was a subject of considerable debate.
Nowadays, the introduction of inmunohistochemical techniques associated to specific antibodies and studies with retrograde tracers in nerves have allowed greater understanding of disc innervation in physiological and pathological conditions and also endings characteristics and their patterns of distribution in both situations. The existing controversies regarding structural basis of discogenic pain, have raised the interest of knowing the influence of innervation in back pain from discal origin and its characteristics.
Today, we know that pathologic neoinnervation accompanying radial fissures is an important factor in the genesis of discogenic pain; within a complex mechanism in which other neurobiomechemical, inflammatory and biomechanical factors are involved.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora