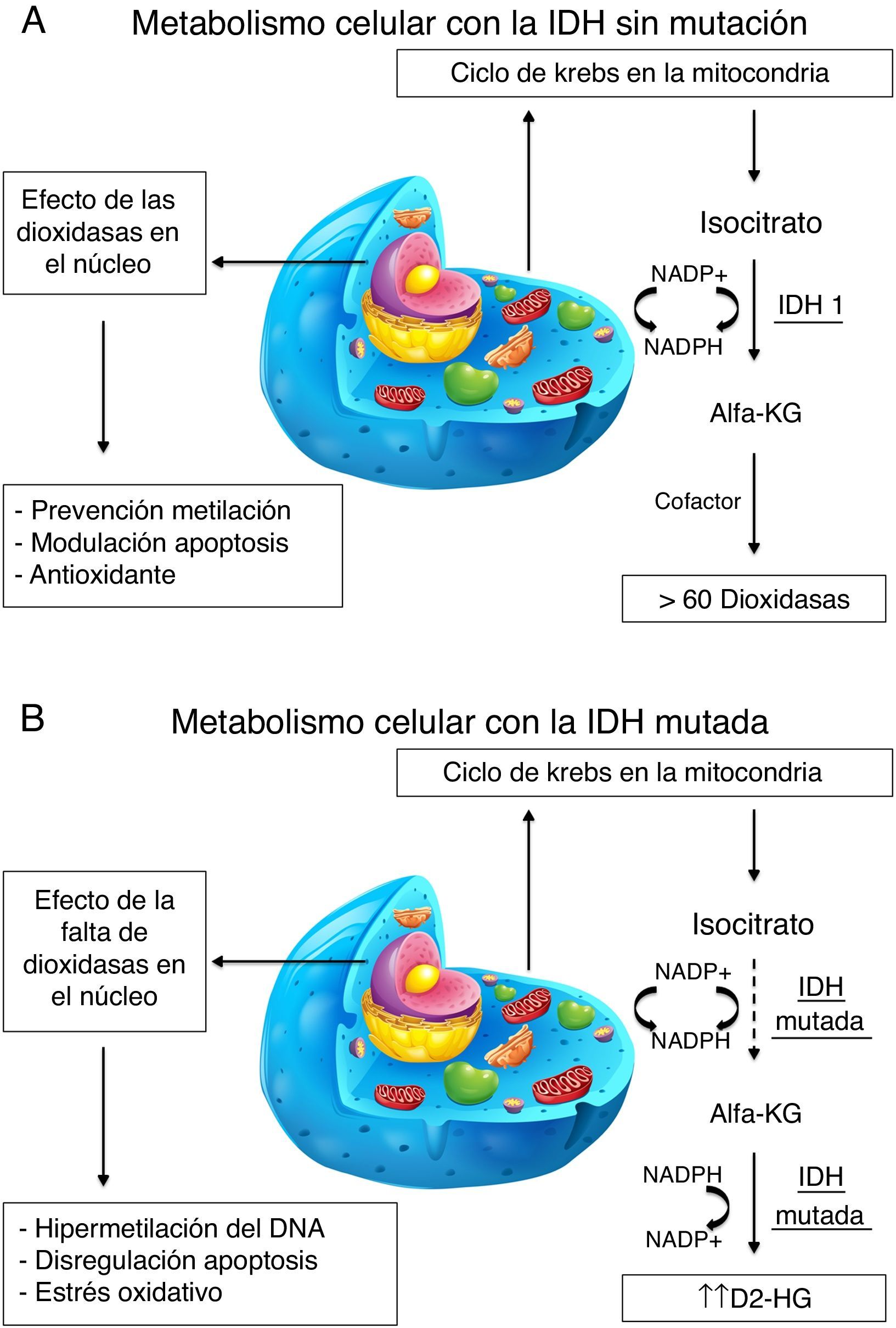
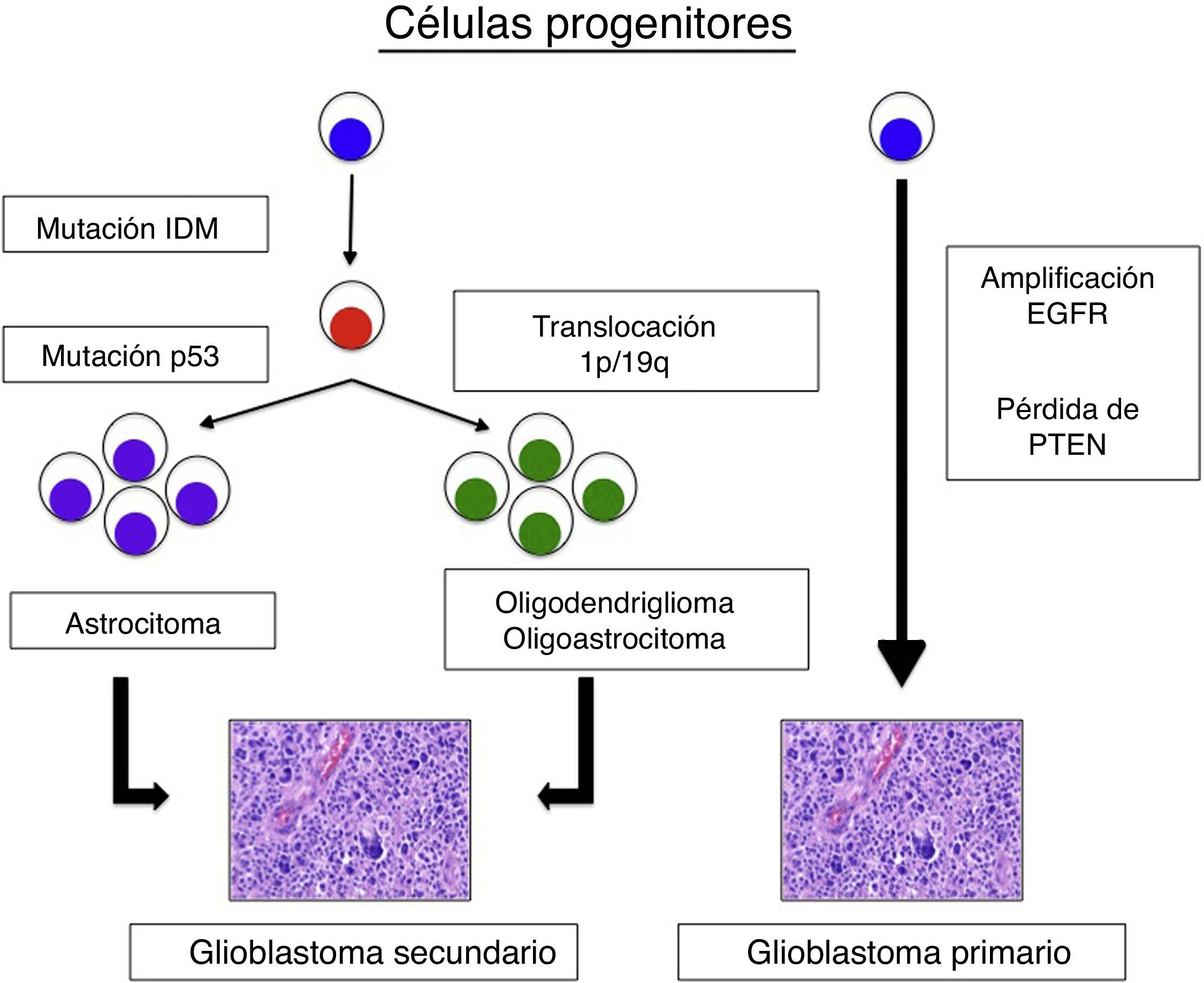
La respuesta al tratamiento y el pronóstico de los glioblastomas multiformes (GBM) puede ser distinta entre diferentes individuos. Este hecho está haciendo que cada vez estén cobrando más importancia los biomarcadores genéticos para intentar diferenciar distintos subtipos de GBM. Uno de los que está adquiriendo más importancia es la isocitrato deshidrogenasa (IDH1). El objetivo del trabajo es analizar la diferencias tanto clínicas como pronósticas de los GBM con y sin mutación de la IDH1.
Materiales y métodoEstudio retrospectivo de pacientes con GBM intervenidos entre los años 2007 y 2012. Los criterios de inclusión fueron: pacientes entre 18-85 años, sometidos por primera vez a cirugía, resección macroscópicamente completa, tratamiento coadyuvante con quimioterapia y radioterapia y Karnofsky status>70.
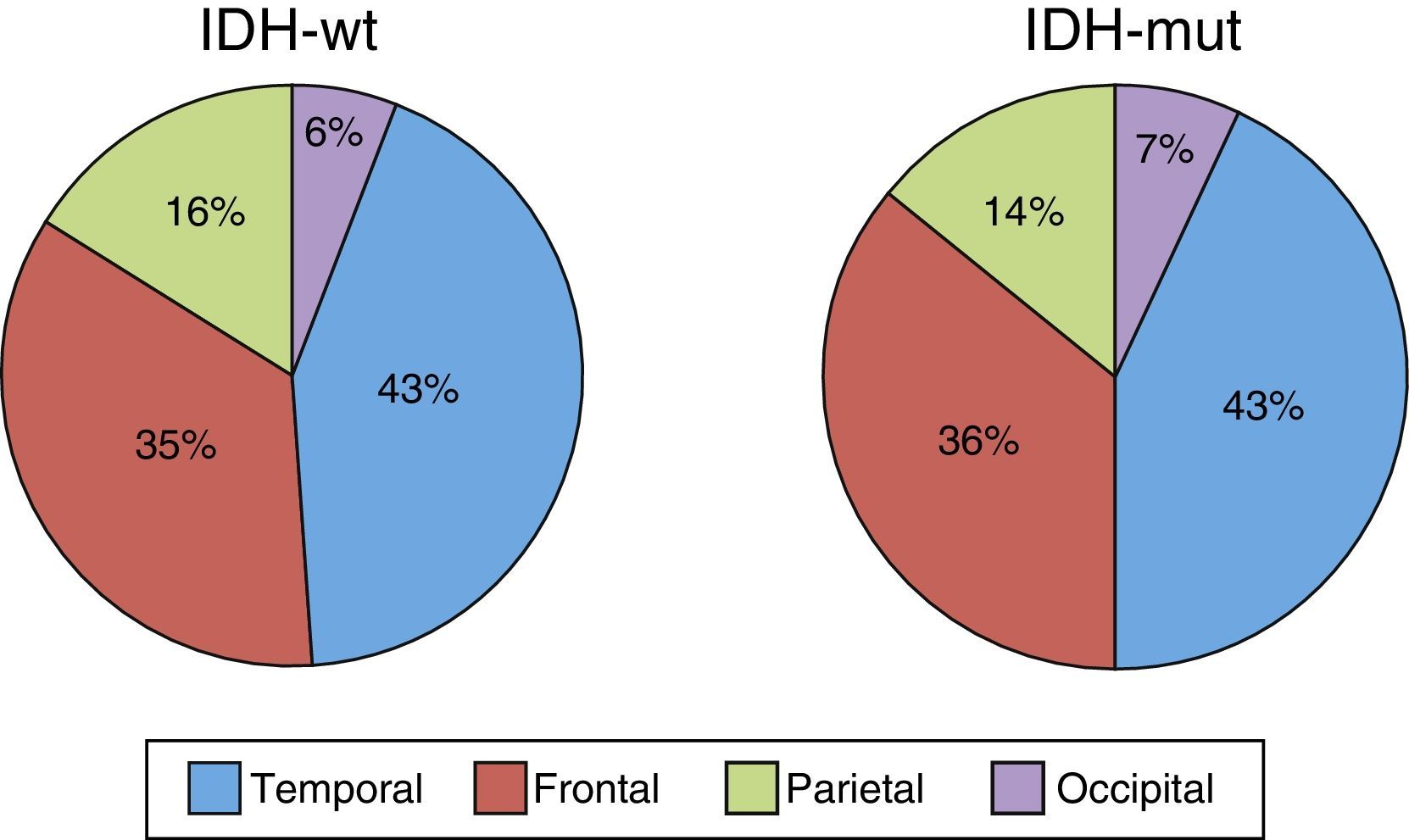
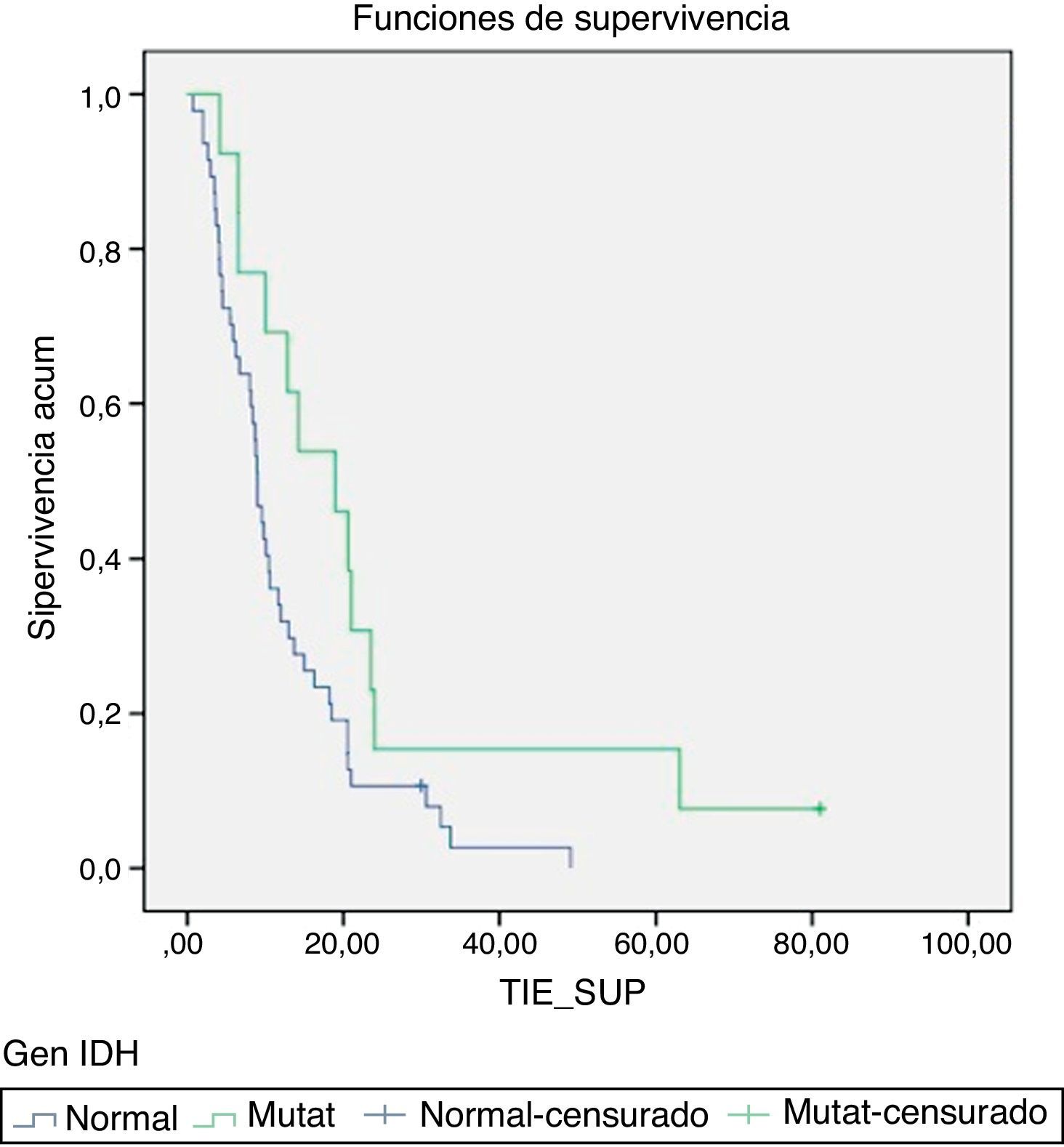
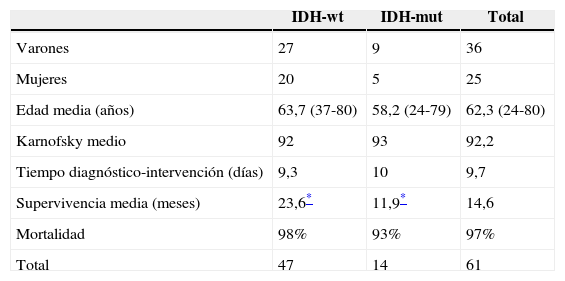
ResultadosN=61 pacientes (36 varones/25 mujeres). Edad media de 62,3 años. En 14 pacientes (23%) se encontró la IDH1 mutada. La supervivencia media de los pacientes con mutación de la IDH1 (IDH1-m) fue de 23,6 meses respecto a los 11,9 meses que presentaban los de la IDH1 en estado natural (IDH1-wt) (p=0,028). Existió una tendencia en los pacientes con IDH1-m a presentar la enfermedad en edades más tempranas 58,7 vs. 63,4 años, pero estas diferencias no fueron significativas.
ConclusionesSe deberían considerar los GBM con IDH1-m como una entidad distinta a los IDH1-wt. Se trata de dos subtipos de GBM con una historia natural y un pronóstico totalmente distinto por lo que se deberían clasificar en un futuro en función de la presencia de la mutación de la IDH1.
Treatment response and prognosis in glioblastoma (GBM) tumours can differ among patients, highlighting the growing relevance of genetic biomarkers to differentiate glioblastoma sub-types. The biomarker isocitrate dehydrogenase (IDH1) is currently receiving considerable attention. The objective of this work was to analyse the clinical and prognostic differences between glioblastomas with and without the IDH1 mutation.
MethodsA retrospective study was performed on patients with GBM who underwent surgery between 2007 and 2012. The inclusion criteria were: patient age between 18-85 years who underwent surgery for the first time with complete macroscopic resection, complete adjuvant treatment with chemotherapy and radiotherapy, and a Karnofsky performance score > 70.
ResultsA total of 61 patients (36 males/25 famales) were included and with a mean age of 62.3 years. An IDH1mutation was found in 14 patients (23%). Median survival in patients with the IDH1 mutation (IDH1-m)was 23.6 months compared with 11.9 months in those with the wild type IDH1 (IDH1-wt) (P=.028). Disease onset in IDH1-m patients tended to be at a younger age, 58.7 vs. 63.4 years, but this difference was not statistically significant.
ConclusionGlioblastomas with IDH1-m should be considered a different entity from the IDH1-wt, as their natural history and prognosis differ. In the near future we should be classified glioblastomas based on the presence of the IDH1 mutation.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".