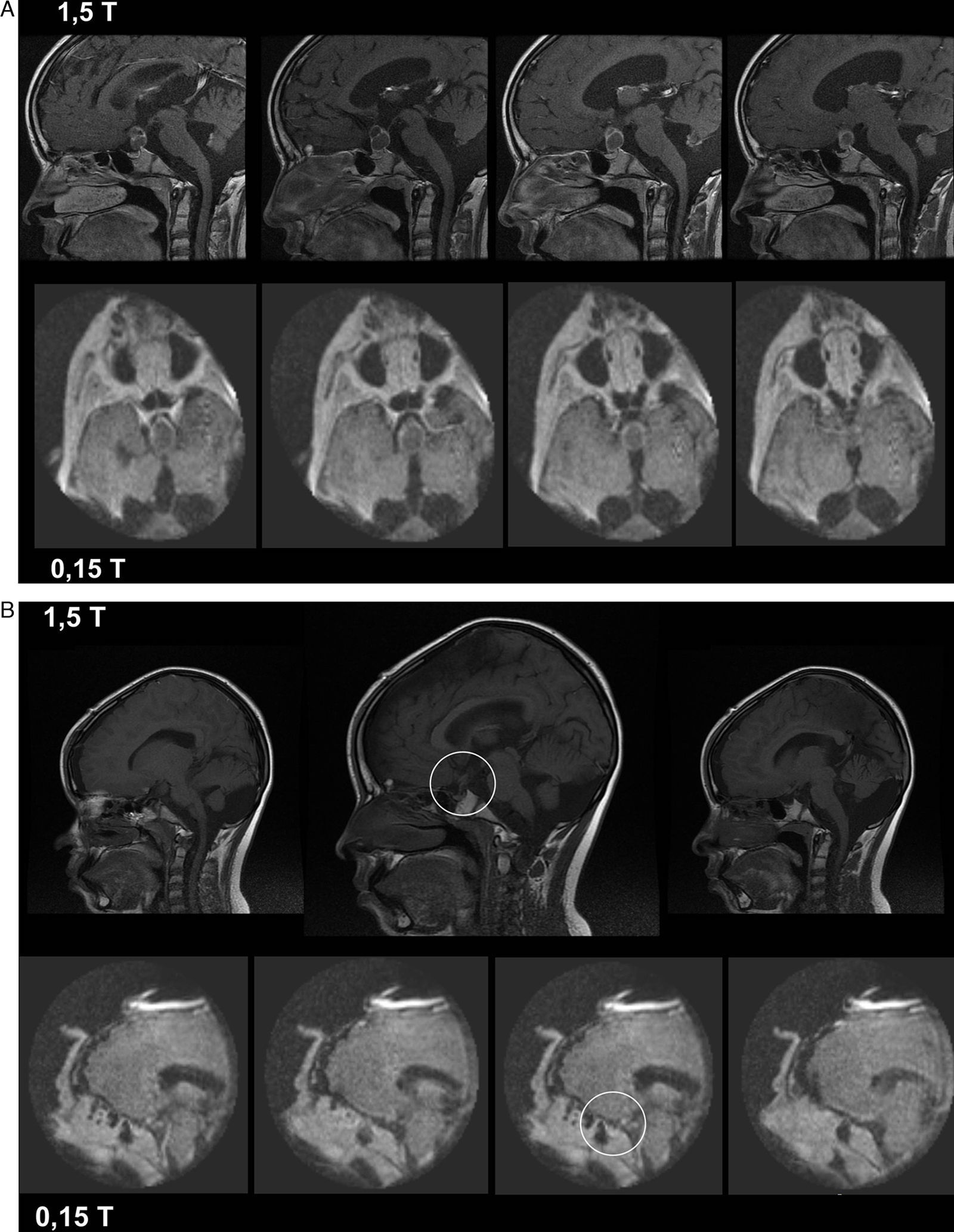
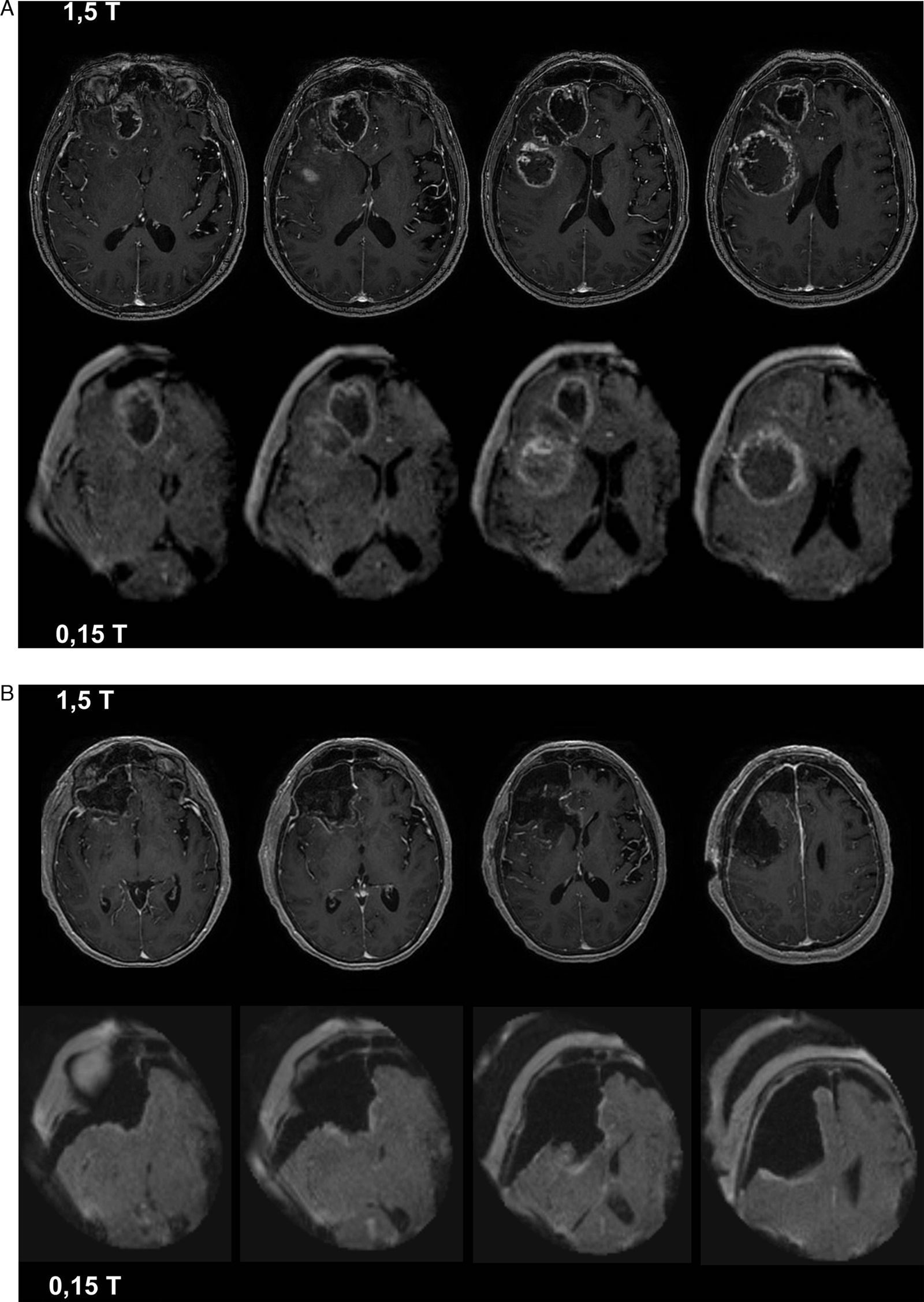
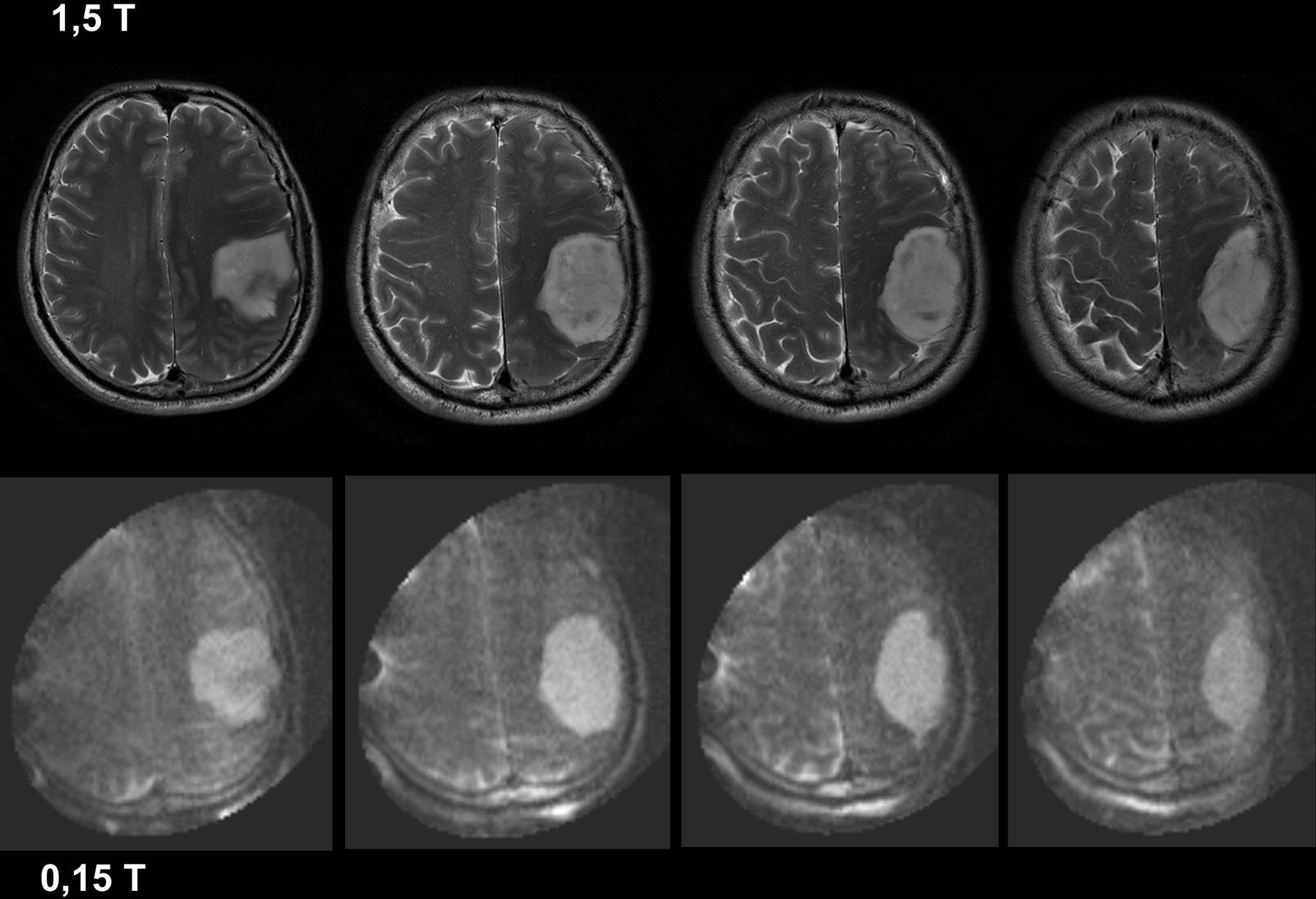
La resonancia magnética intraoperatoria (RMiop) es considerada el estándar de oro de entre todas las técnicas de imagen intraoperatoria disponibles. Su principal aplicación es la detección de enfermedad residual durante las resecciones tumorales. Presentamos nuestra experiencia inicial en el primer servicio de neurocirugía de un hospital de la red sanitaria pública española que ha dispuesto de una RMiop de bajo campo. Valoramos su utilidad y precisión para detectar enfermedad residual, comparando los resultados de las imágenes intraoperatorias con los de las pruebas de control post-operatorio realizadas con equipos de diagnóstico convencionales.
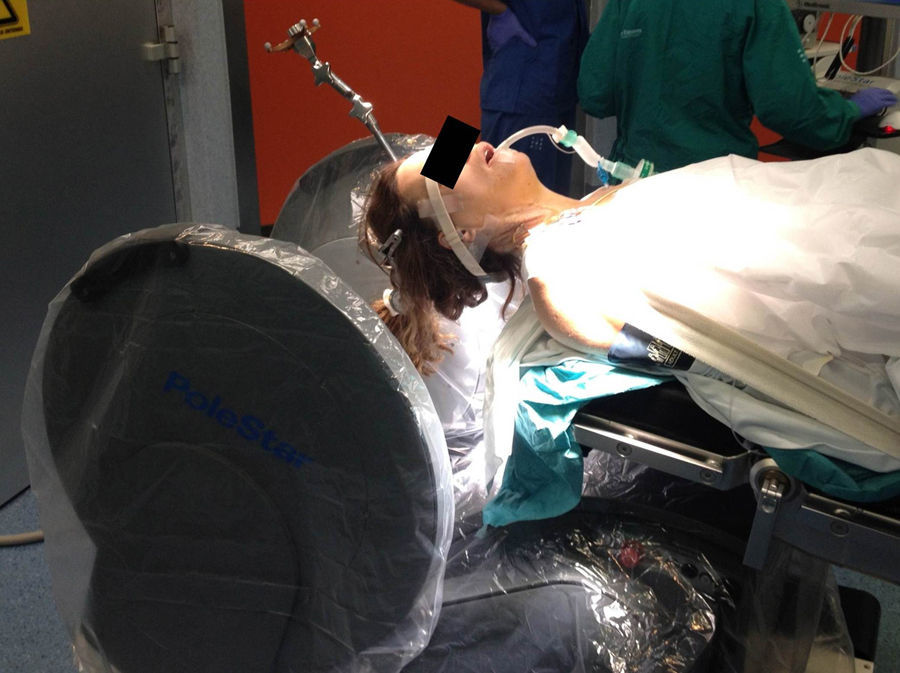
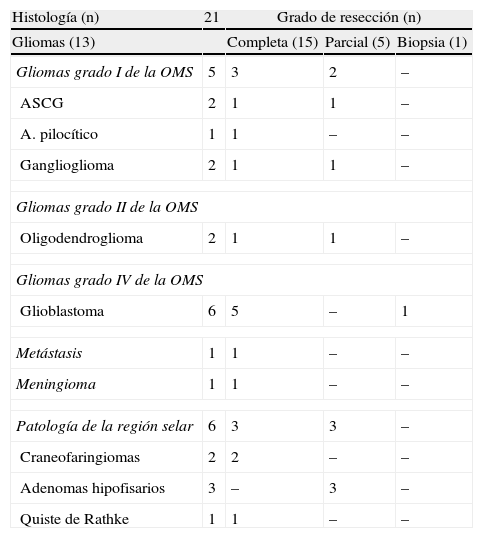
Material y métodosRevisamos retrospectivamente los primeros 21 pacientes intervenidos con ayuda de esta tecnología. En todos se estableció como objetivo quirúrgico la máxima resección segura. Se empleó instrumental convencional y los asistentes convenientes en cada caso.
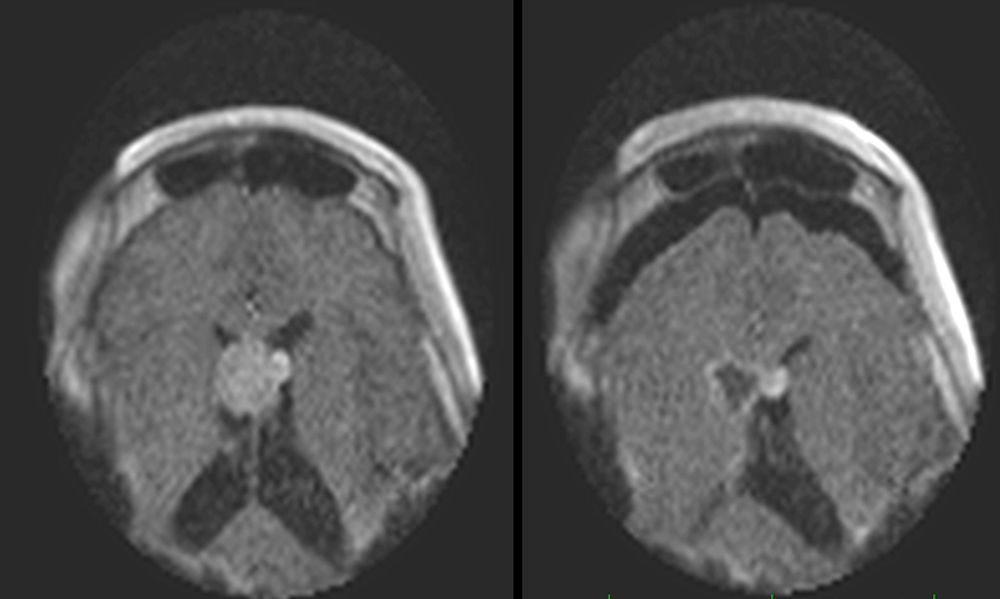
ResultadosEl número medio de estudios obtenidos en cada intervención fue de 2,3 (rango 2-4). Las imágenes intraoperatorias confirmaron que el objetivo preoperatorio se había logrado en 15 pacientes (71,4%), y condujeron a ampliar la resección tumoral tras detectar la presencia de restos tumorales en 6 (28,5%). Tras comparar la última imagen intraoperatoria con las imágenes de control post-operatorias, 2 casos (9,5%) fueron considerados como falsos negativos.
ConclusionesLa RMiop es una herramienta segura, fiable y útil en la cirugía de los tumores cerebrales. Los equipos de bajo campo ofrecen imágenes de calidad aceptable y suficiente a un menor coste económico, por lo que su universalización parece más viable.
Intraoperative MRI is considered the gold standard among all intraoperative imaging technologies currently available. Its main indication is in the intraoperative detection of residual disease during tumour resections. We present our initial experience with the first intraoperative low-field MRI in a Spanish hospital of the public healthcare system. We evaluate its usefulness and accuracy to detect residual tumours and compare its intraoperative results with images obtained postoperatively using conventional high-field devices.
Material and methodsWe retrospectively reviewed the first 21 patients operated on the aid of this technology. Maximal safe resection was the surgical goal in all cases. Surgeries were performed using conventional instrumentation and the required assistance in each case.
ResultsThe mean number of intraoperative studies was 2.3 per procedure (range: 2 to 4). Intraoperative studies proved that the surgical goal had been achieved in 15 patients (71.4%), and detected residual tumour in 6 cases (28.5%). After comparing the last intraoperative image and the postoperative study, 2 cases (9.5%) were considered as “false negatives”.
ConclusionsIntraoperative MRI is a safe, reliable and useful tool for guided resection of brain tumours. Low-field devices provide images of sufficient quality at a lower cost; therefore their universalisation seems feasible.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora