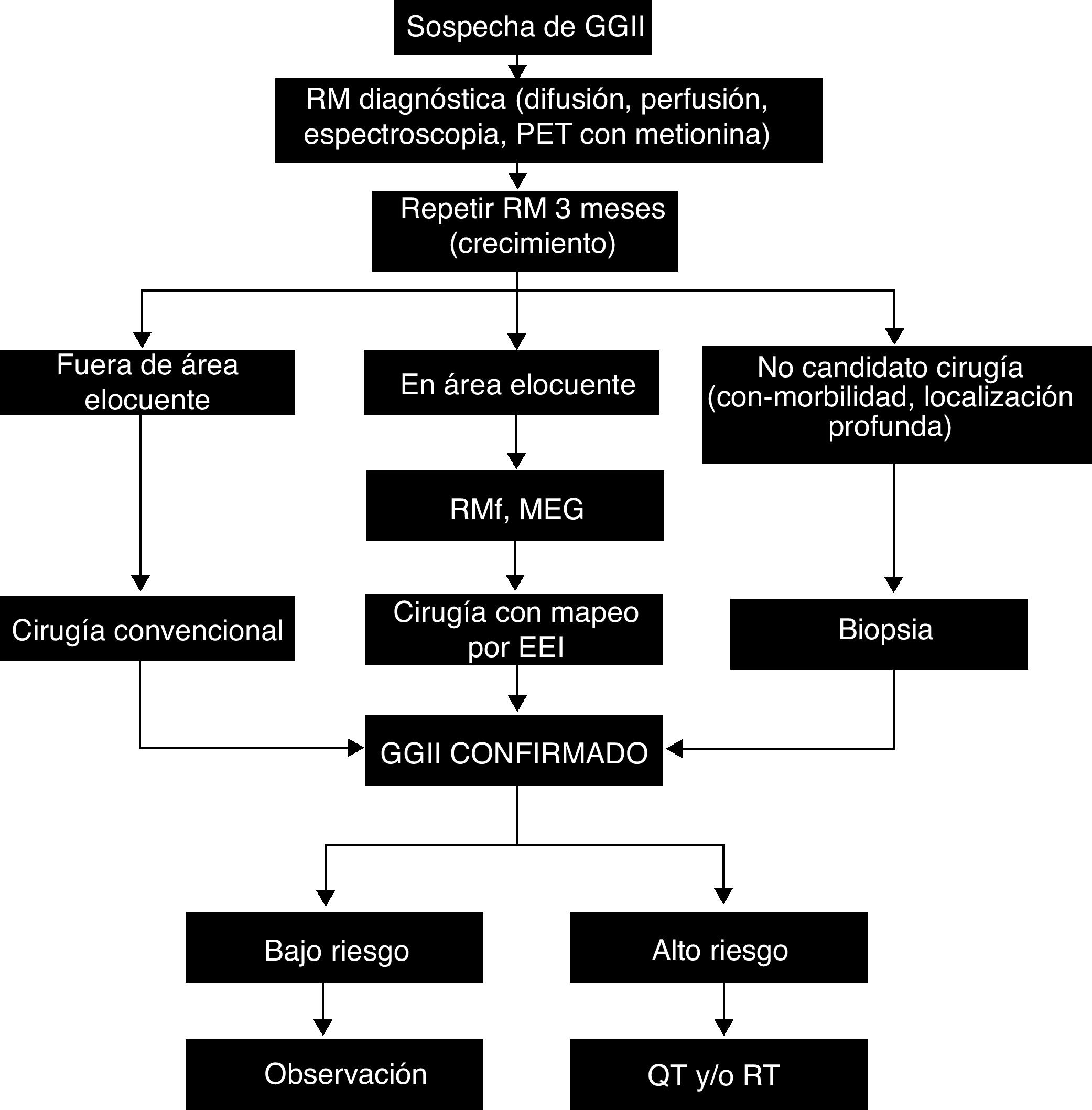
El manejo de los gliomas difusos OMS grado II (GGII) es a día de hoy controvertido. Algunos autores proponen una actitud expectante, con seguimiento radiológico a largo plazo, otros proponen realizar una biopsia y plantear un tratamiento solo si hay signos clínicos o radiológicos de progresión, y por último otros proponen un tratamiento activo desde el diagnóstico. En los últimos años han aparecido varios estudios que pueden ayudar a aclarar estas controversias. En este trabajo se revisa la literatura reciente con a intención de aclarar algunos puntos controvertidos en el manejo de los GGII. Las secuencias convencionales de resonancia magnética (RM) y otras técnicas de neuroimagen más recientes, como la espectroscopia multivoxel o la tomografía por emisión de positrones (PET) con metionina, carecen de la fiabilidad suficiente para realizar un diagnóstico definitivo de GGII. La biopsia estereotáxica es poco invasiva, pero conduce a errores diagnósticos en GGII hasta en el 71% de los casos, lo que se ha asociado a errores en el muestreo y a la variabilidad interobservador por la escasa muestra obtenida. Por todo ello, se considera actualmente que el diagnóstico definitivo de GGII solo se consigue mediante el análisis histológico de la muestra obtenida tras la extirpación máxima del tumor. Respecto al impacto pronóstico de la cirugía, no existe evidencia clase I, pero hay fuertes indicios provenientes de estudios de cohorte con gran número de pacientes y seguimiento a largo plazo de que la extirpación extensa tiene un impacto positivo en la supervivencia y en el tiempo hasta la malignización del tumor. El tratamiento quirúrgico es también efectivo para controlar la epilepsia, ya que consigue mejorías en epilepsias farmacorresistentes hasta en el 76% de los casos. Por todo ello, la cirugía es considerada cada vez por un mayor número de profesionales como un paso fundamental para el diagnóstico y tratamiento de estos tumores. La radioterapia incrementa el tiempo hasta la progresión, pero no aumenta la supervivencia y además produce trastornos cognitivos que afectan a la calidad de vida, por eso cada vez más se prefiere diferir este tratamiento hasta que hay evidencia de malignización.
The optimal management of diffuse WHO grade II gliomas (GGII) is still controversial. Some authors propose a long-term radiological follow-up of the tumor, others perform a biopsy and treat only if clinical or radiological signs of progression, finally, others propose an active treatment from diagnosis. There is mounting evidence that suggest that expectant management is no longer optimal, supporting active treatment from diagnosis. In the present work, an extensive review of the recent literature was performed, in order to clarify some of these controversies. Neuroimaging techniques, such as magnetic resonance imaging (MRI), multivoxel spectroscopy or methionine positron emission tomography (PET), give valuable information about the tumor, but lack of sufficient reliability to make a definitive diagnosis of GGII. Stereotactic biopsy leads to misdiagnosis in up to 71% of cases, which has been associated with sampling errors and inter-observer variability due to the small sample obtained. Therefore, it is now considered that a definitive diagnosis of GGII requires a detailed histological analysis of the sample after maximum tumor removal. Despite the lack of class I evidence, there is growing evidence from cohort studies, favoring extensive surgical resection to improve survival and time to tumor degeneration. Surgery is also effective to treat epilepsy, as an improvement in up to 76% of drug-resistant epilepsies has been documented. Consequently, surgery is now considered as a crucial step for diagnosis and treatment of these tumors. Early radiotherapy after surgery lengthens the period without progression but does not affect overall survival, and is related to cognitive disorders that affect quality of life. Hence, this treatment could be deferred until tumor progression.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora