Analizar las variables clínicas, radiológicas y terapéuticas de las fístulas durales arteriovenosas (FDAV) intracraneales tratadas en nuestro centro, y analizar la validez de las clasificaciones de Borden y Cognard y su correlación con la presentación clínica.
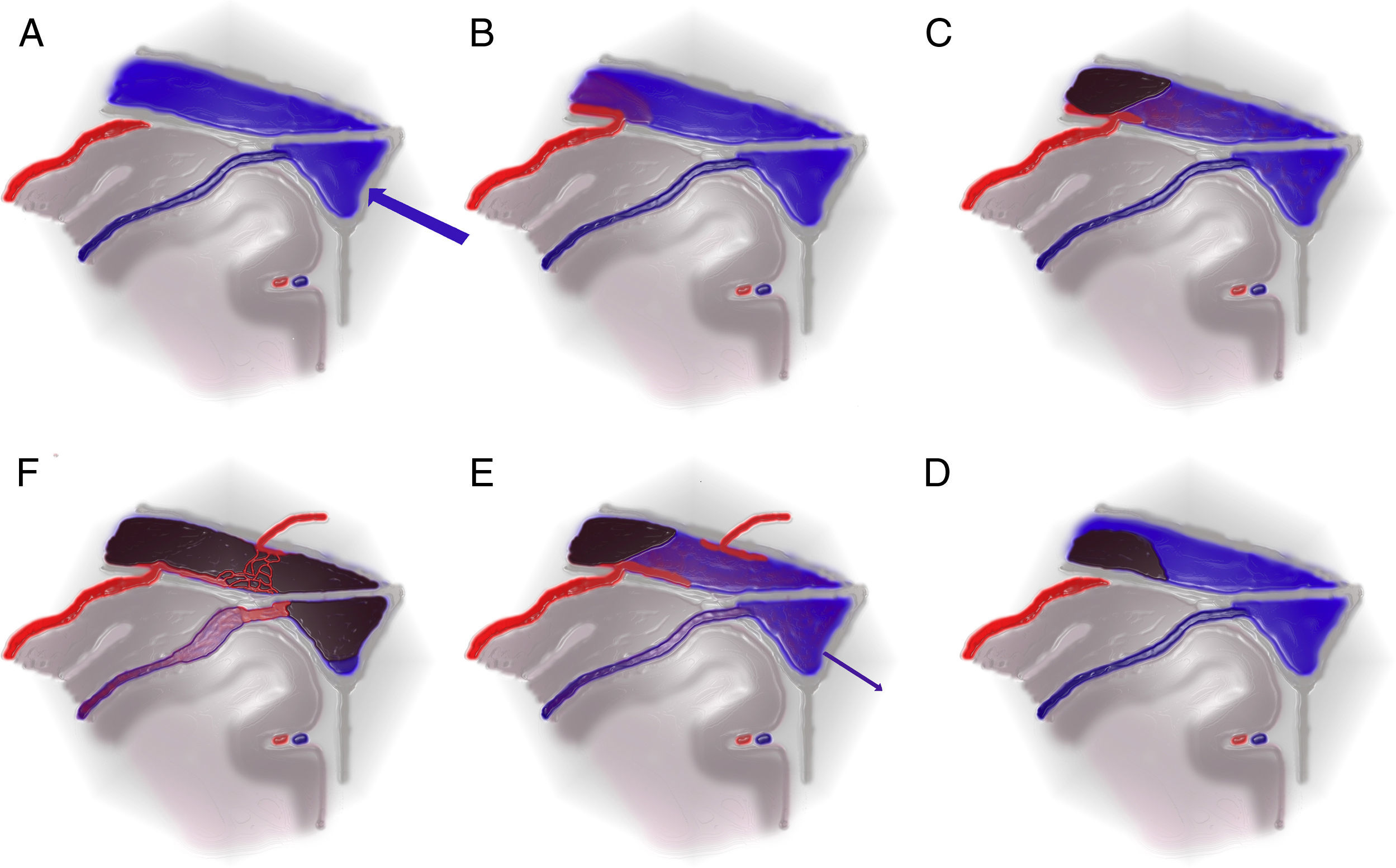
Material y métodosSe ha realizado un análisis retrospectivo de las FDAV identificadas. Se ha clasificado en función de la localización, del patrón de drenaje venoso y según las clasificaciones de Borden y Cognard, y se ha correlacionado con el modo de presentación. Se han descrito los tratamientos, sus complicaciones y su eficacia.
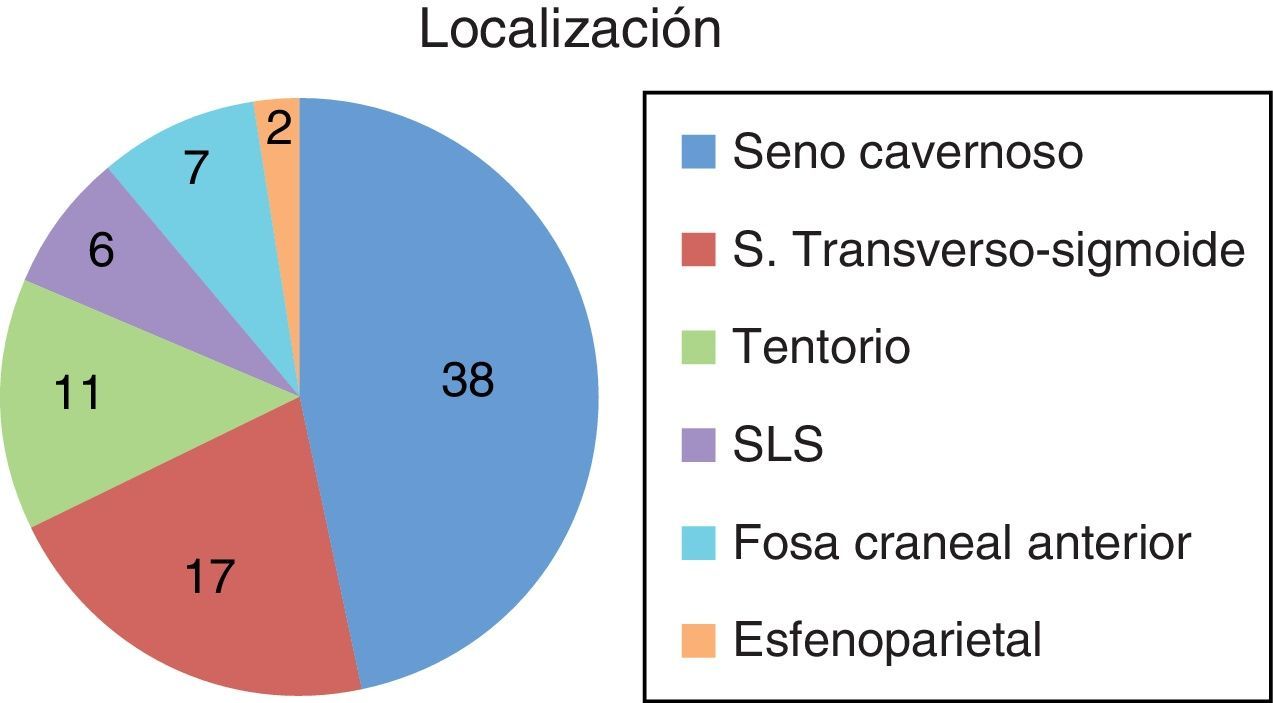
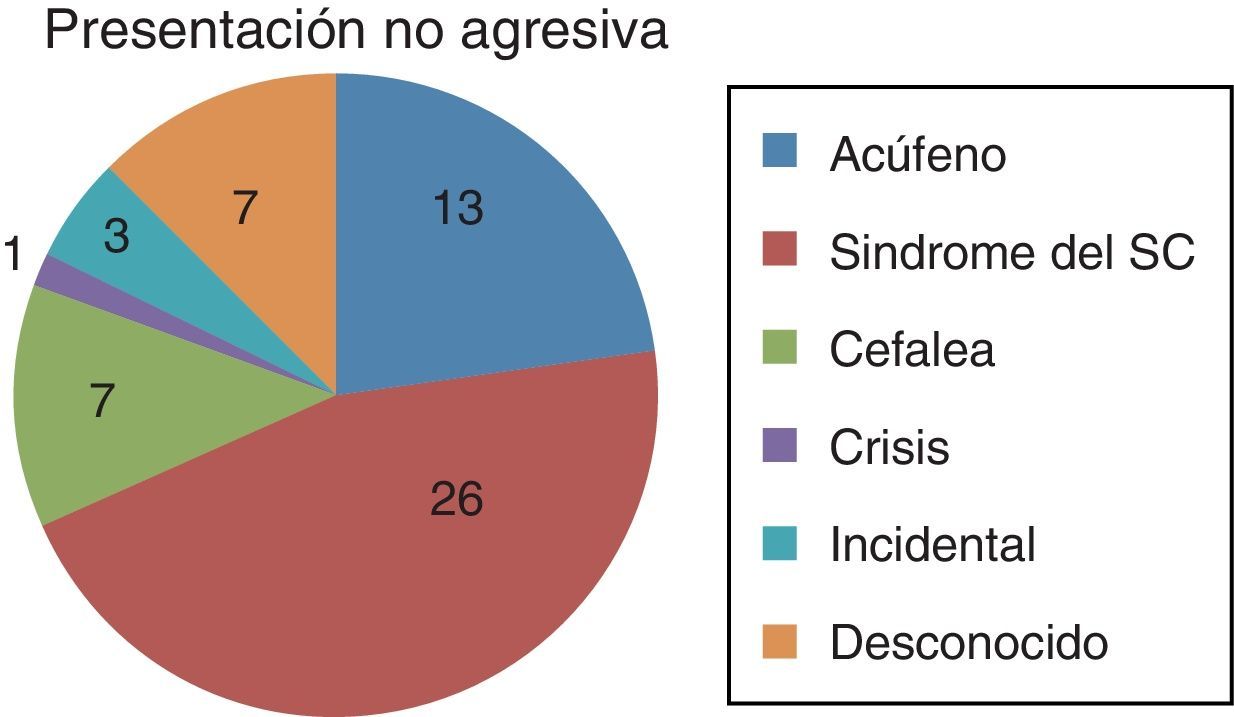
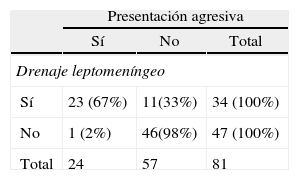
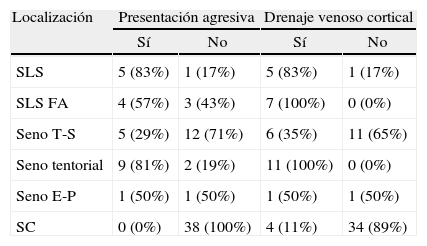
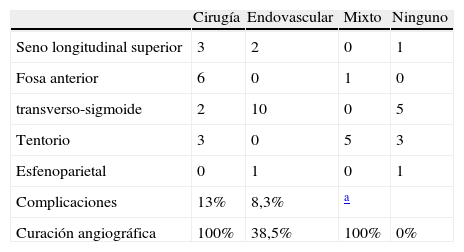
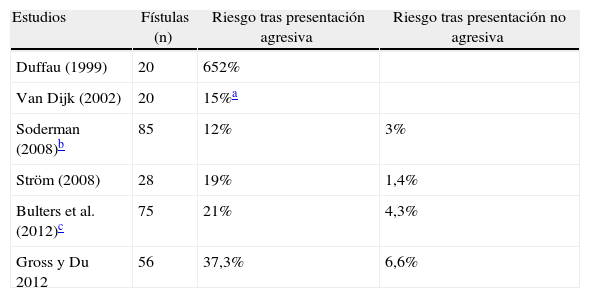
ResultadosEntre 1975 y 2012 se identificaron 81FDAV. La localización en el seno cavernoso (SC) fue la más frecuente. Las clasificaciones de Borden y Cognard presentaron un índice Kappa interobservador de 0,72 y 0,76, respectivamente. La odds ratio de presentación agresiva en presencia de drenaje venoso cortical (DVC) fue de 19,3 (2,8-132,4). Ninguna localización, ajustada por patrón de drenado venoso, se asoció a presentación agresiva. El tratamiento endovascular transarterial de las FDAV del seno cavernoso presentó una mejoría sintomática en más del 78% de los casos, con una tasa de complicaciones del 5%. Las FDAV con DVC tratadas quirúrgicamente presentaron una curación del 100%, sin complicaciones asociadas.
ConclusionesLa presencia de DVC se asoció significativamente a presentaciones agresivas. Las clasificaciones de Borden y Cognard presentan poca variabilidad interobservador. El tratamiento endovascular de las FDAV del SC es seguro y relativamente efectivo. El tratamiento quirúrgico de las FDAV con DVC es seguro y eficaz, y de elección en nuestro medio.
To analyse the clinical, radiological and therapeutic variables of intracranial dural arteriovenous fistulae (DAVF) treated at our institution, and to assess the validity of the Borden and Cognard classifications and their correlation with the presenting symptoms.
Material and methodsThe DAVF identified were retrospectively analysed. They were classified according to their location, drainage pattern and the Borden and Cognard classifications. We recorded the different treatments, their complications and efficacy.
ResultsThere were 81DAVF identified between 1975 and 2012. The cavernous sinus (CS) location was the most frequent one. The Borden and Cognard classifications showed an interobserver Kappa index of 0.72 and 0.76 respectively. The odds ratio of aggressive presentation in the presence of cortical venous drainage (CVD) was 19.3 (2.8-132.4). No location, once adjusted by venous drainage pattern, showed significant association with an aggressive presentation. Endovascular transarterial treatment of cavernous sinus DAVF achieved symptomatic improvement of 78%, with a complication rate of 5%. The DAVF of non-CS locations, with CVD, treated surgically were angiographically shown cured in 100% of the cases, with no treatment-related complications.
ConclusionsThe presence of CVD was significantly associated with aggressive presentations. The Borden and Cognard classifications showed little interobserver variability. Endovascular treatment for CS DAVF is safe and relatively effective. Surgical treatment of non-CS DAVF with CVD is safe, effective and the first choice treatment in our environment.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora