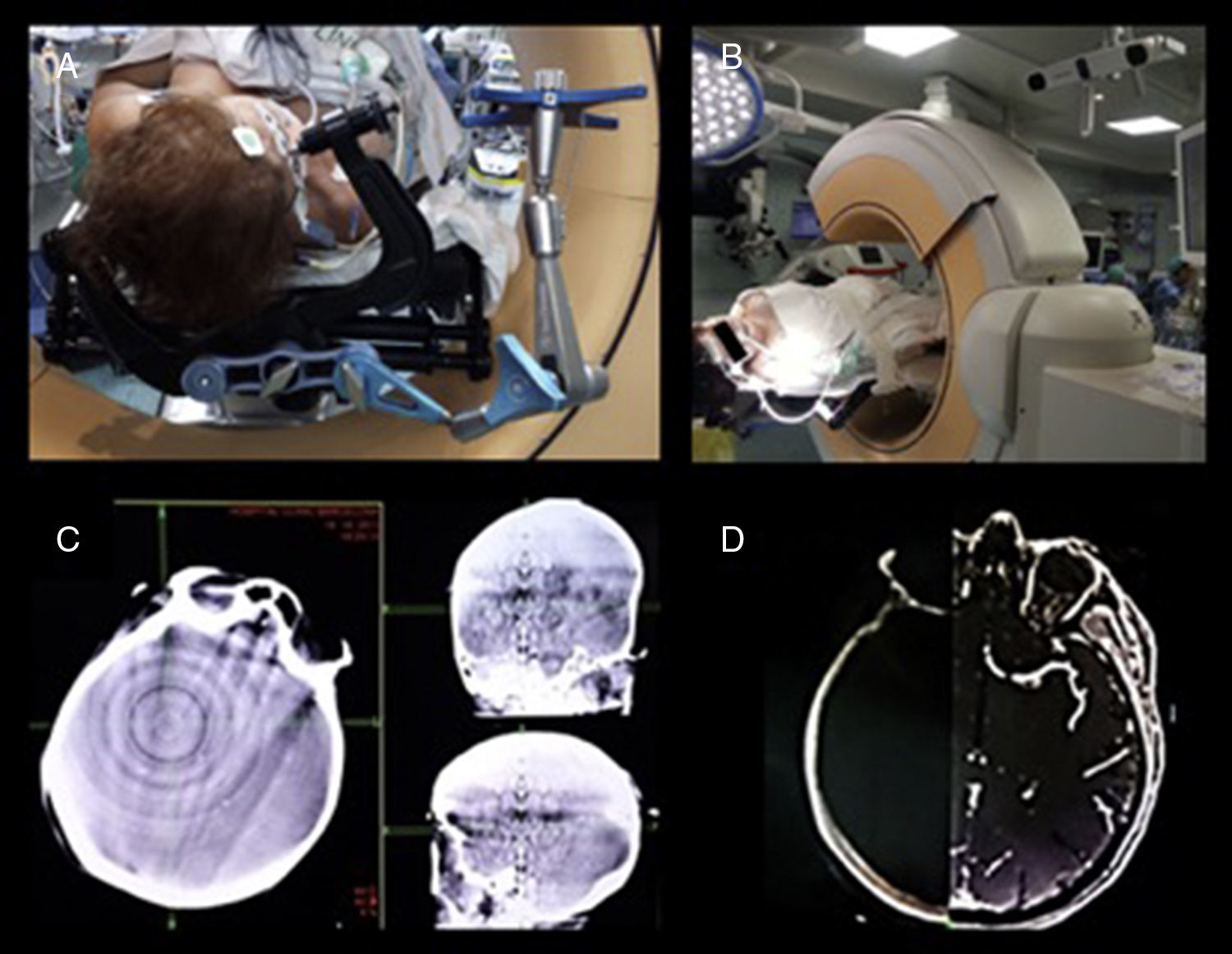
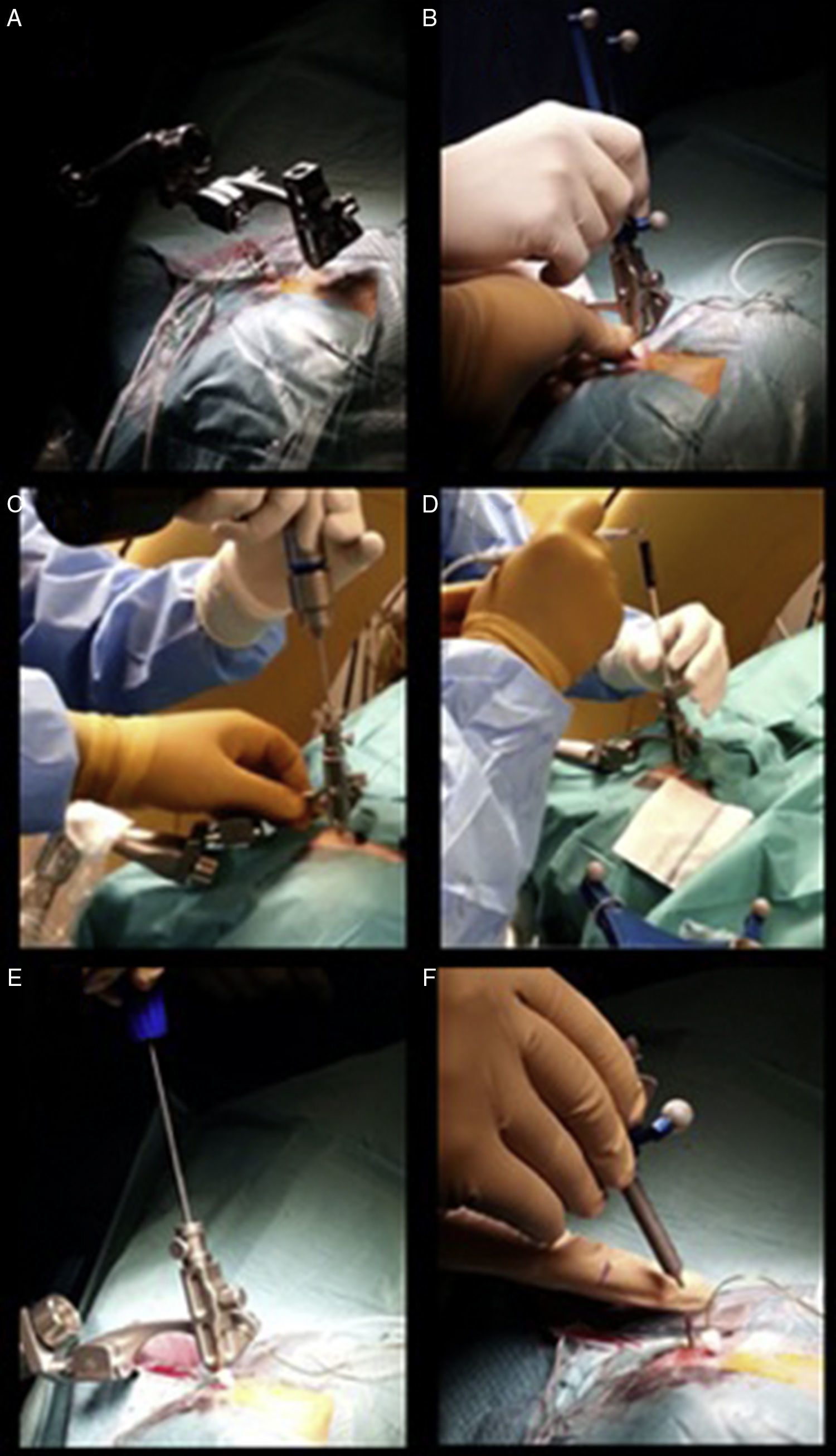
Presentar una técnica novedosa, precisa y segura para la implantación de electrodos profundos destinados al registro de la actividad eléctrica cerebral o SEEG, sin marco estereotáctico, mediante la asistencia de neuronavegación, TC intraoperatorio O-Arm®, y el uso del brazo articulado pasivo Vertek®.
Material y métodosTodos los pacientes a los que se les implantaron electrodos profundos para SEEG mediante está técnica en el Hospital Clínic de Barcelona fueron incluidos. De forma prospectiva evaluamos la precisión de la técnica, las complicaciones posquirúrgicas, el tiempo quirúrgico, la estancia media y los resultados a corto plazo.
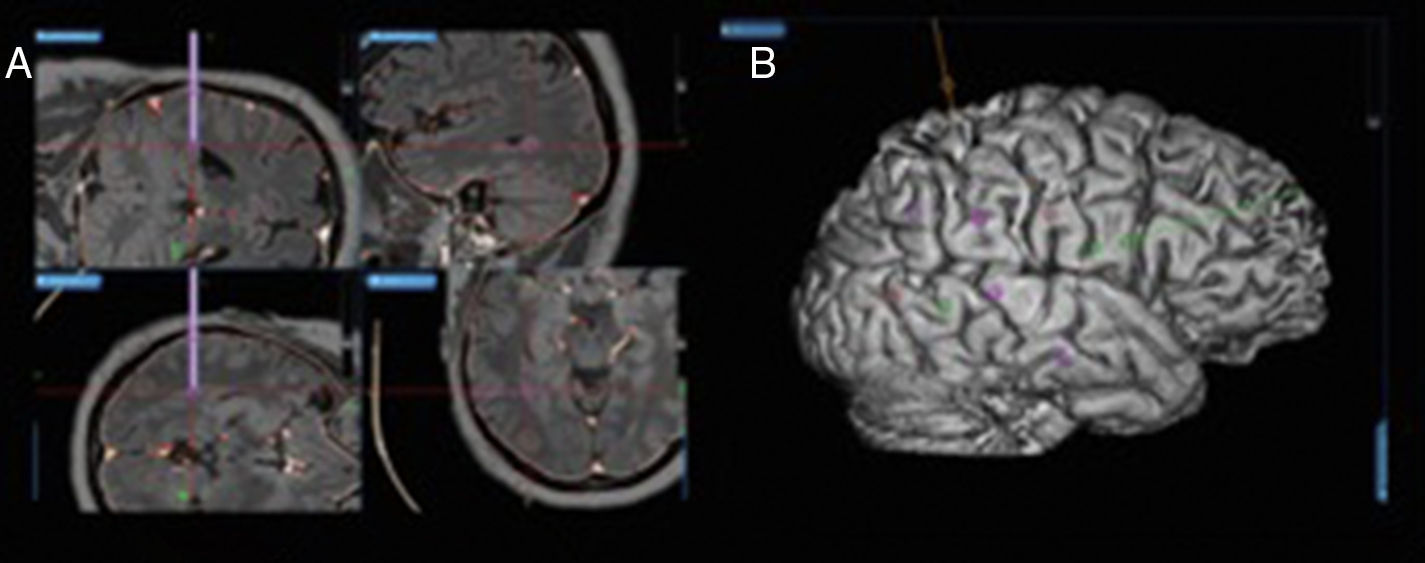
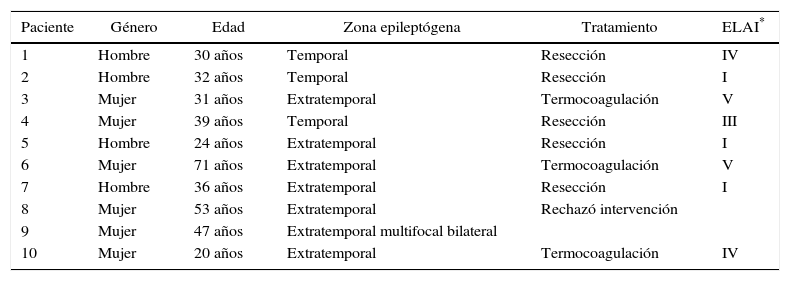
ResultadosUn total de 10 pacientes fueron intervenidos mediante está técnica. La media de edad fue de 38 años, 60% de los casos fueron mujeres. La media de electrodos por paciente fue de 6,9 (3-10), con un total de 69 electrodos implantados. El tiempo medio quirúrgico fue de 34,7 min por electrodo. La distancia media entre la diana planificada y la definitiva fue de 1,39mm (0,95-1,7). No se presentaron complicaciones posquirúrgicas. Se detectó foco epileptógeno en 6 casos (60%). Se realizó cirugía resectiva en 5 casos (50%), en 3 casos (30%) se realizó termocoagulación y en 2 casos (20%) no se realizó ningún tratamiento. A los 6 meses de seguimiento, de los 8 casos tratados, 37,5% presentan ELAI I, 12,5% ELAI III, 25% ELAI IV y 25% ELAI V.
ConclusionesLa colocación de electrodos profundos para SEEG realizada mediante la utilización de brazo articulado pasivo Vertek® y TC intraoperatorio O-Arm® es una técnica segura, efectiva y con una adecuada precisión.
To report a novel, accurate, and safe technique for deep brain electrode implantation to register brain electrical activity or SEEG, using frameless stereotaxy, neuronavigation assisted, and intraoperative CT-guided O-Arm® and the Vertek® articulated passive arm.
Material and methodsAll patients implanted by this technique in Barcelona Hospital Clinic were included. A prospective evaluation was made of the accuracy of the technique, as well as complications, surgical time, length of stay, and short-term outcomes.
ResultsThe study included 10 patients that underwent this procedure. The mean age was 38 years, and 60% were women. A mean of 6.9 (3-10) electrodes/patient, with a total of 69 electrodes, were implanted. The mean time for implantation was 34.7minutes per electrode. The mean distance between the planned target and the final target was 1.39 millimetres (0.95-1.7). There were no surgically derived complications. The epileptogenic zone was determined in 6 cases (60%). Surgical resection was performed in 5 cases (50%), with thermocoagulation in 3 (30%) cases, and in 2 cases (20%) there was no treatment. At a six-month follow-up of the 8 treated cases, 37.5% were ELAI I, 12.5% ELAI III, 25% ELAI IV, and 25% ELAI V.
ConclusionsThe implantation of deep brain electrodes for SEEG by using intraoperative CT O-Arm® and the Vertek® articulated passive arm is a safe and effective technique with adequate accuracy.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".