Determinar la eficacia diagnóstica y la incidencia de complicaciones perioperatorias en pacientes sometidos a biopsia cerebral cerrada o por craneotomía, y valorar la duración de la vigilancia intensiva, para el diagnóstico precoz y el manejo de las complicaciones posoperatorias.
Material y métodoEstudio observacional retrospectivo, incluyendo todos los pacientes sometidos a biopsia cerebral entre enero de 2006 y julio de 2012. Se recogieron los datos demográficos, enfermedad asociada, tipo de biopsia, datos relevantes del intraoperatorio, el resultado de la anatomía patológica, la realización de prueba de imagen cerebral y su resultado, y la presencia, tipo y momento de aparición de las complicaciones posoperatorias.
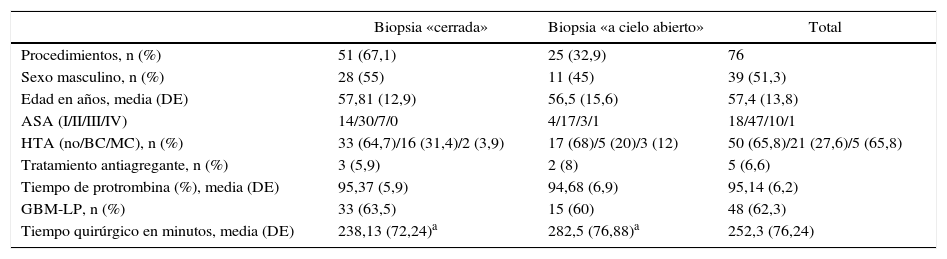
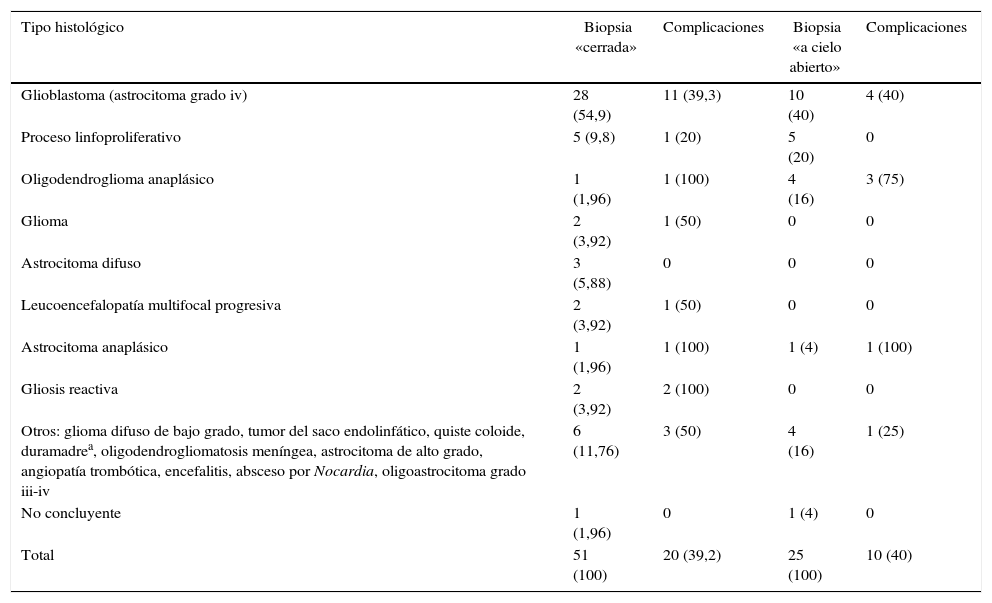
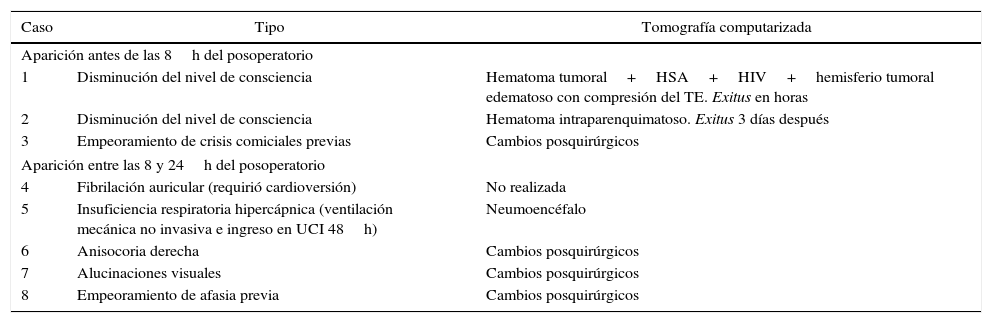
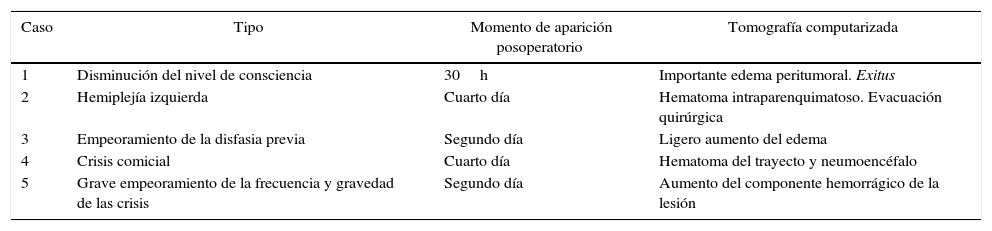
ResultadosSe analizaron un total de 76 biopsias (51 «cerradas», 25 «abiertas») en 75 pacientes. La efectividad diagnóstica fue del 98% en las «cerradas» y del 96% en las «abiertas». La mortalidad relacionada con el procedimiento fue de 3,9 y 4%, respectivamente. La incidencia de complicaciones mayores fue del 3,9% en biopsias «cerradas» y del 8% en biopsias «abiertas», apareciendo la mitad de ellas dentro de las primeras 24h del posoperatorio, durante el ingreso en la Unidad de Cuidados Intensivos. La edad fue el único factor de riesgo para la aparición de complicaciones (p=0,04). No encontramos diferencias de morbimortalidad entre los 2 grupos analizados.
ConclusionesLa eficacia diagnóstica de nuestra serie ha sido muy alta. Dada la importancia del diagnóstico precoz de las complicaciones, recomendamos una vigilancia monitorizada en las primeras 24h tras la realización de una biopsia cerebral tanto «abierta» como «cerrada».
To assess the diagnostic yield and the incidence of perioperative complications in patients undergoing an open or closed cerebral biopsy and to determine the length of intensive care monitoring, for early diagnosis and fast management of perioperative complications.
Material and methodThis was a retrospective analysis of all the patients that underwent brain biopsy between January 2006 and July 2012. We recorded demographic data, comorbidities, modality of biopsy, intraoperative clinical data, histological results, computed tomography scanning findings and occurrence, and type of perioperative complications and moment of appearance.
ResultsSeventy-six brain biopsies in 75 consecutive patients (51 closed and 25 open) were analysed. Diagnostic yield was 98% for closed biopsies and 96% for open biopsies. Mortality related to the procedures was 3.9 and 4%, respectively. The incidence of major complications was 3.9% for closed biopsies and 8% for open biopsies; half of these appeared within the first 24 postoperative hours, during patient stay in the Intensive Care Unit. Age was the only risk factor for complications (P=.04) in our study. No differences in morbimortality were found between the studied groups.
ConclusionsDiagnostic yield was very high in our series. Because the importance of early diagnosis of complications for preventing long-term sequelae, we recommend overnight hospital stay for observation after open or closed brain biopsy.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora