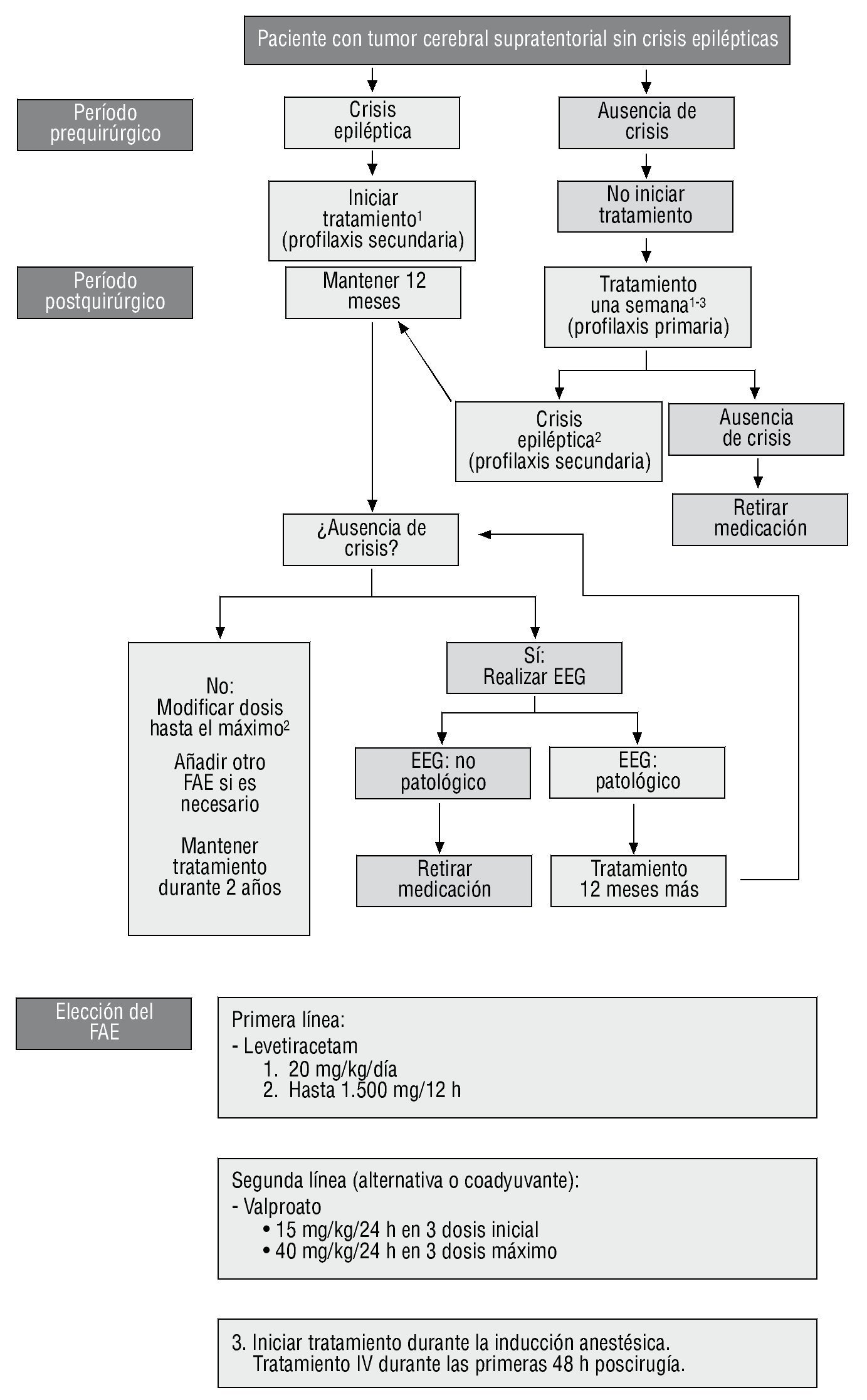
Con la finalidad de proponer una serie de recomendaciones del tratamiento médico antiepiléptico, en el perioperatorio de los tumores cerebrales supratentoriales, se realiza una revisión de la literatura enfocada sobre todo a la profilaxis primaria de las crisis epilépticas precoces acaecidas en el postoperatorio inmediato.
Se concluye que es recomendable pautar profilaxis primaria antiepiléptica poscirugía durante una semana en los pacientes con tumor cerebral supratentorial que no han presentado crisis epilépticas. Si las crisis aparecen durante la evolución de la enfermedad, es necesario pautar un tratamiento a largo plazo. Dadas las características de estos pacientes, se recomienda usar un fármaco antiepiléptico con presentación por vía intravenosa y un perfil bajo de interacciones. El levetiracetam, seguido del valproato, parecen ser los más adecuados.
Dichas recomendaciones deben considerarse como una guía general de manejo, pudiendo ser modificadas, incluso de manera significativa, por las circunstancias propias de cada caso clínico.
Our review of the literature is basically focused on the primary prophylaxis of early seizures after surgery of cerebral supratentorial tumors, with the aim of suggesting several recommendations in medical antiepileptic treatment to avoid this kind of seizures which occur immediately after surgery.
In conclusion, it is recommended to provide criteria for prophylaxis of early seizures after surgery of cerebral supratentorial tumors. It´s recommended a one week treatment with antiepileptic drugs in patients who didn´t have seizures jet, starting immediately after the surgical treatment. If seizures appear during progress of the disease, a large period treatment will be needed. Preferred antiepileptic treatment is intravenous and with a low interactions profile. Levetiracetam, followed by valproic acid seem to be most appropriated drugs due to their properties and protective effects, particularly for our patients requirements.
These recommendations are considered a general proposal to effective clinical management of early seizures after surgery, not taking into account the single circumstances of our patients. Always, clinical features of the patients could modify even significantly these guides in the benefit of each patient.
Artículo

Si es la primera vez que accede a la web puede obtener sus claves de acceso poniéndose en contacto con Elsevier España en suscripciones@elsevier.com o a través de su teléfono de Atención al Cliente 902 88 87 40 si llama desde territorio español o del +34 932 418 800 (de 9 a 18h., GMT + 1) si lo hace desde el extranjero.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla clicando aquí y seleccionando la opción "He olvidado mi contraseña".
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora